题目内容
20.如图所示实验能鉴别的一组物质是( )
| A. | 区分淀粉溶液和鸡蛋清溶液 | B. | 鉴别乙酸和乙醇 | ||
| C. | 鉴别自来水与豆浆 | D. | 鉴别乙酸乙酯与饱和Na0H溶液 |
分析 由实验图可知,利用丁达尔现象鉴别物质,则选项中两种物质必然有一种为胶体,以此来解答.
解答 解:A.淀粉溶液和鸡蛋清溶液均为胶体分散系,丁达尔现象不能鉴别,故A不选;
B.乙酸和乙醇均不能发生丁达尔现象,不能鉴别,故B不选;
C.豆浆为胶体分散系,自来水为溶液,则丁达尔现象可鉴别,故C选;
D.乙酸乙酯与饱和Na0H溶液均不能发生丁达尔现象,不能鉴别,故D不选;
故选C.
点评 本题考查物质鉴别和检验,为高频考点,把握物质的性质、发生的反应和现象为解答的关键,侧重分析与应用能力的考查,注意丁达尔现象为胶体特有的性质,题目难度不大.

练习册系列答案
相关题目
10.下图为元素周期表前四周期的一部分,且X、Y、Z、R和W为主族元素.下列说法正确的是( )
| X | |||
| Y | X | R | |
| W |
| A. | 五种元素可能都是金属元素 | |
| B. | 五种元素的原子最外层电子数一定都大于2 | |
| C. | X的氢化物的沸点一定比Z的氢化物的沸点高 | |
| D. | R的最高价氧化物对应的水化物一定是强酸 |
8.下列物质间离子方程式书写正确的是( )
| A. | 相同物质的量浓度的FeI2溶液与Br2水溶液等体积混合:2Fe2++2I-+2Br2═2Fe3++I2+4Br- | |
| B. | 向Ba(OH)2溶液中加入过量NH4HSO4溶液:NH4++Ba2++2OH-+H++SO42-═BaSO4↓+NH3•H2O+H2O | |
| C. | 向漂白粉溶液中通入过量的SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| D. | 四氧化三铁溶于氢碘酸溶液中:Fe3O4+8H++2I-═3Fe2++I2+4H2O |
11.随着环保意识增强,清洁能源越来越受到人们关注.
(1)甲烷是一种理想的洁净燃料.已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ•mol-1
H2O(1)═H2O(g),△H=+44.0kJ•mol-l
则4.8g甲烷气体完全燃烧生成液态水,放出的热量为267.1kJ.
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值.
该反应为CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206.1kJ•mol-l.
①若800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表.
则此时正、逆反应速率的关系是a.(填序号)
a.v(正)>v(逆) b.v(正)<v(逆)
c.v(正)=v(逆) d.无法判断
②为了探究温度、压强对上述化学反应速率的影响,某学习小组进行了以下三组对比实验(温度为360℃或480℃、压强为101kPa或303kPa,其余实验条件见下表).
表中P1=303,P2=101;
实验2、3的目的是探究温度对化学反应速率的影响.
实验1、2、3中反应的化学平衡常数的大小关系是K1=K3<K2 (用K1、K2、K3表示).
(1)甲烷是一种理想的洁净燃料.已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ•mol-1
H2O(1)═H2O(g),△H=+44.0kJ•mol-l
则4.8g甲烷气体完全燃烧生成液态水,放出的热量为267.1kJ.
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值.
该反应为CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206.1kJ•mol-l.
①若800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表.
| CH4 (g) | H2O (g) | CO (g) | H2 (g) |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
a.v(正)>v(逆) b.v(正)<v(逆)
c.v(正)=v(逆) d.无法判断
②为了探究温度、压强对上述化学反应速率的影响,某学习小组进行了以下三组对比实验(温度为360℃或480℃、压强为101kPa或303kPa,其余实验条件见下表).
| 实验序号 | 温度/℃ | 压强/kPa | V(CH4)/mol•L-1•s-1 | V(H2O)/mol•L-1•s-1 |
| 1 | 360 | P1 | 0.100 | 0.100 |
| 2 | 480 | 101 | 0.120 | 0.120 |
| 3 | 360 | P2 | 0.080 | 0.080 |
实验2、3的目的是探究温度对化学反应速率的影响.
实验1、2、3中反应的化学平衡常数的大小关系是K1=K3<K2 (用K1、K2、K3表示).
12.下列反应的离子方程式正确的是( )
| A. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3 H2O═Fe(OH)3↓+3 H+ | |
| B. | 用小苏打治疗胃酸过多:HCO3ˉ+H+═CO2↑+H2O | |
| C. | 实验室用浓盐酸与MnO2反应制氯气:2Cl-+MnO2+2H+=Mn2++2H2O+Cl2↑ | |
| D. | 用FeCl3溶液腐蚀电路板:Fe3++Cu═Fe2++Cu2+ |

 如图所示,常温下电解5min后,铜电极质量增加1,08g,试回答:
如图所示,常温下电解5min后,铜电极质量增加1,08g,试回答: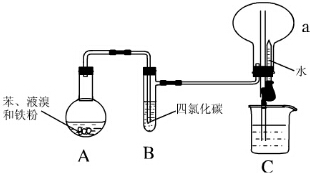 Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应.
Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应. .
.