题目内容
 现用中和滴定法测定某烧碱溶液的浓度,有关数据记录如下:
现用中和滴定法测定某烧碱溶液的浓度,有关数据记录如下:| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的液体 | ||
| 1 | 25.00 | 0.50 | 26.80 | 26.30 |
| 2 | 25.00 | |||
| 3 | 25.00 | 5.00 | 31.34 | 26.34 |
(2)现实验室中有石蕊和酚酞两种指示剂,该实验应选用
(3)根据所给数据,该烧碱样品的物质的量浓度为
(4)若操作过程中滴加盐酸速度过快,未充分振荡,刚看到溶液变色,就立刻停止滴定,则会造成测定结果
(5)对于pH=4的NH4Cl溶液,写出其显酸性的原因
考点:中和滴定
专题:实验题
分析:(1)根据酸性溶液存放在酸式滴定管中;根据滴定管的结构以及测量体积的原理来分析;滴定管中液体的体积大于其量程
(2)石蕊变色范围较大,而且颜色变化不易观察,不能作酸碱指示剂;
(3)根据c(NaOH)=
计算;
(4)若操作过程中滴加盐酸速度过快,未充分振荡,刚看到溶液变色,就立刻停止滴定,氢氧化钠没有完全被中和;
(5)铵根离子水解显酸性;溶液显酸性,铵根离子水解,氯离子不水解,据此判断离子浓度大小;根据物料守恒和电荷守恒分析;稀释10n倍,pH变化小于n个单位.
(2)石蕊变色范围较大,而且颜色变化不易观察,不能作酸碱指示剂;
(3)根据c(NaOH)=
| c(HCl)×V(HCl) |
| V(NaOH) |
(4)若操作过程中滴加盐酸速度过快,未充分振荡,刚看到溶液变色,就立刻停止滴定,氢氧化钠没有完全被中和;
(5)铵根离子水解显酸性;溶液显酸性,铵根离子水解,氯离子不水解,据此判断离子浓度大小;根据物料守恒和电荷守恒分析;稀释10n倍,pH变化小于n个单位.
解答:
解:(1)盐酸是酸性溶液,存放在酸式滴定管中;滴定前读数为:0.20mL,滴定后读数为:24.80mL,消耗溶液的体积为24.60mL;滴定管中液体的体积大于其量程,则滴定结束时滴定管中剩余液体的体积大于50.00ml-24.80ml=25.20mL;
故答案为:酸;24.60;>;
(2)石蕊变色范围较大,而且颜色变化不易观察,不能作酸碱指示剂;因此该实验应选用酚酞作指示剂;
故答案为:酚酞;
(3)消耗的盐酸的体积为V(HCl)=
=26.32mL,则c(NaOH)=
=
=0.2632 mol/L;
故答案为:0.2632 mol/L;
(4)若操作过程中滴加盐酸速度过快,未充分振荡,刚看到溶液变色,就立刻停止滴定,氢氧化钠没有完全被中和,消耗的盐酸的体积偏小,由c(NaOH)=
可知,测定结果偏低;
故答案为:偏低;
(5)铵根离子水解显酸性,其水解的方程式为:NH4++H2O NH3?H2O+H+;氯化铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,NH4++H2O?NH3.H2O+H+
NH3?H2O+H+;氯化铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,NH4++H2O?NH3.H2O+H+
,所以c(H+)>c(OH-),铵根离子水解、钠离子不水解,所以c(Cl-)>c(NH4+),铵根离子水解较微弱,所以c(NH4+)>c(H+),所以溶液中离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-);溶液中的物料守恒为c(Cl-)=c(NH4+)+c(NH3?H2O),电荷守恒为c(Cl-)+c(OH-)=c(H+)+c(NH4+),则c(H+)-c(NH3?H2O)=c(OH-)=1×10-10mol/L;稀释10n倍,pH变化小于n个单位,则将其用水稀释十倍,则其pH变化值小于1,即pH<5;
故答案为:NH4++H2O NH3?H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-);1×10-10mol/L;<.
NH3?H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-);1×10-10mol/L;<.
故答案为:酸;24.60;>;
(2)石蕊变色范围较大,而且颜色变化不易观察,不能作酸碱指示剂;因此该实验应选用酚酞作指示剂;
故答案为:酚酞;
(3)消耗的盐酸的体积为V(HCl)=
| 26.30ml+26.34ml |
| 2 |
| c(HCl)×V(HCl) |
| V(NaOH) |
| 0.2500mol/L×0.02632L |
| 0.02500L |
故答案为:0.2632 mol/L;
(4)若操作过程中滴加盐酸速度过快,未充分振荡,刚看到溶液变色,就立刻停止滴定,氢氧化钠没有完全被中和,消耗的盐酸的体积偏小,由c(NaOH)=
| c(HCl)×V(HCl) |
| V(NaOH) |
故答案为:偏低;
(5)铵根离子水解显酸性,其水解的方程式为:NH4++H2O
 NH3?H2O+H+;氯化铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,NH4++H2O?NH3.H2O+H+
NH3?H2O+H+;氯化铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,NH4++H2O?NH3.H2O+H+,所以c(H+)>c(OH-),铵根离子水解、钠离子不水解,所以c(Cl-)>c(NH4+),铵根离子水解较微弱,所以c(NH4+)>c(H+),所以溶液中离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-);溶液中的物料守恒为c(Cl-)=c(NH4+)+c(NH3?H2O),电荷守恒为c(Cl-)+c(OH-)=c(H+)+c(NH4+),则c(H+)-c(NH3?H2O)=c(OH-)=1×10-10mol/L;稀释10n倍,pH变化小于n个单位,则将其用水稀释十倍,则其pH变化值小于1,即pH<5;
故答案为:NH4++H2O
 NH3?H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-);1×10-10mol/L;<.
NH3?H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-);1×10-10mol/L;<.
点评:本题考查了中和滴定实验、盐的水解原理的应用、溶液中守恒关系的应用,题目难度中等,侧重于考查学生的实验能力和对基础知识的综合应用能力.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
以NA表示阿伏伽德罗常数,下列有关说法正确的是( )
| A、3.4gNH3中含N-H键数目为0.2NA |
| B、14 g乙烯和丙烯的混合物中总原子数为3NA |
| C、2.24LCO2与足量的Na2O2反应,反应中转移的电子总数为0.1NA |
| D、理论上氢氧燃料电池正极消耗11.2 L标准状况下气体时,外电路通过电子数为NA |
一定量的浓硝酸与足量的铜反应(后期加热),得到对氢气的相对密度为28的混合气体,该气体通过水后,体积缩小了
,则混合气体中含NO2的体积百分含量为( )
| 1 |
| 3 |
| A、85.5% |
| B、66.7% |
| C、33.3% |
| D、27.4% |
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,11.2L SO3中所含有的原子数2NA |
| B、实验室中用4mol HCl的浓盐酸跟足量MnO2 加热反应可制得的Cl2分子数为NA |
| C、25℃时,pH=13的1.0L Ba(OH)2溶液中含有OH-的数目为0.2NA |
| D、2.3g钠与一定量的氧气完全反应,转移的电子数一定为0.1NA |
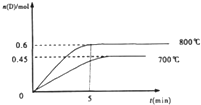 2L容积不变的密闭容器中,加入1.0molA和2.2molB,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图,试回答下列问题:
2L容积不变的密闭容器中,加入1.0molA和2.2molB,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图,试回答下列问题:
 Ⅰ.下列有关仪器的使用,能实现的是
Ⅰ.下列有关仪器的使用,能实现的是