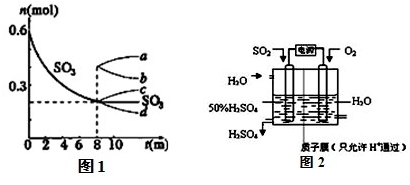
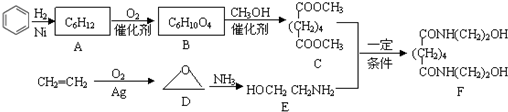
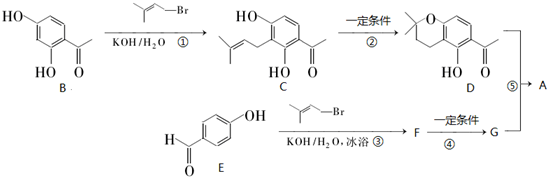
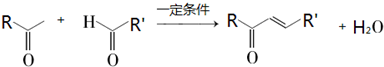
题目内容
将Mg、Zn混合物2.19g溶于200mL5mol/L盐酸中,反应后盐酸的浓度变为4.6mol/L(溶液体积变化忽略不计).求:
(1)反应消耗HCl的物质的量.
(2)该混合物中Mg、Zn的物质的量.
(1)反应消耗HCl的物质的量.
(2)该混合物中Mg、Zn的物质的量.
考点:有关混合物反应的计算
专题:计算题
分析:(1)利用n=cV,根据反应前HCl的物质的量减去反应后溶液中HCl的物质的量来计算;
(2)设Mg、Zn的物质的量分别为x、y,根据金属的质量之和为2.19g及反应中消耗的HCl,利用方程式列式计算.
(2)设Mg、Zn的物质的量分别为x、y,根据金属的质量之和为2.19g及反应中消耗的HCl,利用方程式列式计算.
解答:
解:(1)消耗HCl的物质的量为0.2 L×5mol?L-1-0.2 L×4.6 mol?L-1=0.08mol,
答:反应中消耗HCl的物质的量为0.08mol;
(2)设Mg、Zn的物质的量分别为x、y
由Mg+2HCl═MgCl2+H2↑、Zn+2HCl═ZnCl2+H2↑
则Mg~2HCl Zn~2HCl
x 2x y 2y
,
解得x=0.01mol、y=0.03mol,
答:该混合物中Mg、Zn的物质的量分别为0.01mol、0.03mol.
答:反应中消耗HCl的物质的量为0.08mol;
(2)设Mg、Zn的物质的量分别为x、y
由Mg+2HCl═MgCl2+H2↑、Zn+2HCl═ZnCl2+H2↑
则Mg~2HCl Zn~2HCl
x 2x y 2y
|
解得x=0.01mol、y=0.03mol,
答:该混合物中Mg、Zn的物质的量分别为0.01mol、0.03mol.
点评:本题考查学生利用金属与酸的反应来进行的简单计算,明确金属与酸反应的化学方程式是解答的关键,并学会利用质量关系、消耗的酸来列式计算即可解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用标准盐酸滴定未知浓度的NaOH溶液,如果测得结果偏低,则产生误差的原因可能是下列叙述中的( )
| A、滴定过程中,初读数平视,末读数俯视 |
| B、锥形瓶用蒸馏水洗净后,未经干燥即进行滴定 |
| C、酸式滴定管未用标准盐酸润洗 |
| D、滴定前酸式滴定管尖嘴部分有气泡,滴定终止时气泡消失 |
下列共价键是极性键的是( )
| A、H-H | B、C-H |
| C、O-H | D、C-C |
 现用中和滴定法测定某烧碱溶液的浓度,有关数据记录如下:
现用中和滴定法测定某烧碱溶液的浓度,有关数据记录如下: DEET在一定条件下,可通过下面的路线来合成:
DEET在一定条件下,可通过下面的路线来合成: