题目内容
一定量的浓硝酸与足量的铜反应(后期加热),得到对氢气的相对密度为28的混合气体,该气体通过水后,体积缩小了
,则混合气体中含NO2的体积百分含量为( )
| 1 |
| 3 |
| A、85.5% |
| B、66.7% |
| C、33.3% |
| D、27.4% |
考点:化学方程式的有关计算
专题:计算题
分析:对氢气的相对密度为28的混合气体,平均分子量为56,浓硝酸与足量的铜反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,NO2分子量为46,NO分子量为30,所以,此时存在2NO2?N2O4,即混合气体是:NO2、N2O4、NO,设生成1mol混合气体,三者的物质的量分别为xmol、ymol、zmol,根据
物质的量以及平均摩尔质量列式,结合气体通过水后,体积缩小了
计算xmol、ymol、zmol.相同条件下,体积百分含量等于物质的量分数.
物质的量以及平均摩尔质量列式,结合气体通过水后,体积缩小了
| 1 |
| 3 |
解答:
解:浓硝酸与足量的铜反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,反应生成的气体NO2分子量为46,NO分子量为30,得到对氢气的相对密度为28的混合气体,平均分子量为56,说明此时存在2NO2?N2O4,即混合气体是:NO2、N2O4、NO,设生成1mol混合气体,三者的物质的量分别为xmol、ymol、zmol,x+y+z=1mol①,平均相对分子质量为56,得46x+92y+30z=56②,气体通过水后,体积缩小了
,即最后气体体积为
,N2O4相当于2个NO2,3NO2+H2O=2HNO3+NO,相当于NO2和N2O4与水反应生成NO,3个NO2生成1个NO,即:,
+z=
③,联①②③解得:x=y=z=
mol,则混合气体中含NO2的体积百分含量为
≈33.3%,
故选C.
| 1 |
| 3 |
| 2 |
| 3 |
| (x+2y) |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| 1 |
| 3 |
故选C.
点评:本题考查氮的化合物的计算,为高频考点,注意隐含条件2NO2?N2O4为解答的关键,侧重考查学生的分析思维能力与解题方法技巧,题目难度中等.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
同温同压下,两个相同容积的容器中,一个盛有NO气体,另一个盛有N2和O2的混合气体,则两容器内的气体一定具有相同的( )
①分子数②原子数③质子数④质量⑤密度⑥物质的量.
①分子数②原子数③质子数④质量⑤密度⑥物质的量.
| A、①② | B、②③⑤ |
| C、②③⑥ | D、①②⑥ |
根据下面的物质转换图,下列说法不正确的是( )
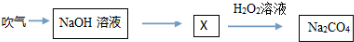

| A、Na2CO4是一种盐,其中碳为+6价 |
| B、X溶液中可能含两种盐 |
| C、该过程中没有发生氧化还原反应 |
| D、NaHCO3与盐酸和氢氧化钠均能反应 |
 现用中和滴定法测定某烧碱溶液的浓度,有关数据记录如下:
现用中和滴定法测定某烧碱溶液的浓度,有关数据记录如下: