题目内容
菱锌矿的主要成分是ZnCO3,还含有少量Fe2O3、FeO、CuO 等杂志,如图是以菱锌矿为原料制取轻质ZnO的一种工艺流程,该流程还可以得到两种副产品--海绵铜和铁红.
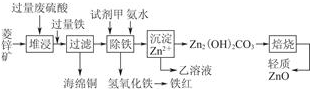
请结合下表数据,回答问题:
(1)“堆浸”前将菱锌矿粉粹成细颗粒,其目的是 ;
(2)下列试剂中, (填代号)可作为试剂甲的首选.
A.KMnO4 B.Cl2 C.H2O2 D.浓硝酸.
根据所选物质写出与之发生反应的离子方程式
(3)除杂质铁步骤中加入氨水的目的是调节溶液的pH,其适宜的pH范围是 ;调节溶液pH时,除了氨水外,还可以加入下列物质中的 .
a.Zn b.ZnO c.Zn(OH)2 d.CuO.

请结合下表数据,回答问题:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.3 | 9.7 |
| Fe3+ | 1.5 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
(2)下列试剂中,
A.KMnO4 B.Cl2 C.H2O2 D.浓硝酸.
根据所选物质写出与之发生反应的离子方程式
(3)除杂质铁步骤中加入氨水的目的是调节溶液的pH,其适宜的pH范围是
a.Zn b.ZnO c.Zn(OH)2 d.CuO.
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:菱锌矿加入过量废硫酸,经充分反应后溶液中存在Fe3+、Fe2+、Zn2+、Cu2+等离子,向滤液M加入过量铁粉,Cu2+被置换成铜单质,通过过滤得到的滤液中含有Fe2+、Zn2+,为得到Zn2(OH)2CO3,则应加入碱以除去杂质Fe2+,由表中数据可知,为防止生成Zn(OH)2沉淀,应先将Fe2+氧化为Fe3+,所加入氧化剂一般为过氧化氢,防止引入新杂质,然后加入氨水调节溶液pH,生成氢氧化铁沉淀,过滤后在滤液中通入二氧化碳,可生成Zn2(OH)2CO3,经焙烧可得到ZnO,以此解答该题.
解答:
解:菱锌矿加入过量废硫酸,经充分反应后溶液中存在Fe3+、Fe2+、Zn2+、Cu2+等离子,向滤液M加入过量铁粉,Cu2+被置换成铜单质,通过过滤得到的滤液中含有Fe2+、Zn2+,为得到Zn2(OH)2CO3,则应加入碱以除去杂质Fe2+,由表中数据可知,为防止生成Zn(OH)2沉淀,应先将Fe2+氧化为Fe3+,所加入氧化剂一般为过氧化氢,防止引入新杂质,然后加入氨水调节溶液pH,生成氢氧化铁沉淀,过滤后在滤液中通入二氧化碳,可生成Zn2(OH)2CO3,经焙烧可得到ZnO,
(1)为了加快反应速率,增大固液接触面积,在“溶解”前将氧化锌粗品粉碎成细颗粒,故答案为:增大固液接触面积,加快溶解时的反应速率;
(2)将Fe2+氧化为Fe3+,所加入氧化剂一般为过氧化氢,防止引入新杂质,反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O,
故答案为:C;H2O2+2Fe2++2H+=2Fe3++2H2O;
(3)铁离子开始沉淀的pH为2.7,完全沉淀时的pH为3.2,锌离子开始沉淀的pH为6.2,所以除去铁离子且不影响锌离子的pH范围为3.2~6.2,除了氨水外,还可加入ZnO、Zn(OH)2等,
故答案为:3.2~6.2;bc.
(1)为了加快反应速率,增大固液接触面积,在“溶解”前将氧化锌粗品粉碎成细颗粒,故答案为:增大固液接触面积,加快溶解时的反应速率;
(2)将Fe2+氧化为Fe3+,所加入氧化剂一般为过氧化氢,防止引入新杂质,反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O,
故答案为:C;H2O2+2Fe2++2H+=2Fe3++2H2O;
(3)铁离子开始沉淀的pH为2.7,完全沉淀时的pH为3.2,锌离子开始沉淀的pH为6.2,所以除去铁离子且不影响锌离子的pH范围为3.2~6.2,除了氨水外,还可加入ZnO、Zn(OH)2等,
故答案为:3.2~6.2;bc.
点评:本题考查学生对工艺流程的理解、阅读获取信息能力、对操作步骤的分析评价、物质的分离提纯、氧化学计算等,是对所学知识的综合运用与能力的考查,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| B、向AlCl3溶液中加入NaAlO2:Al3++3AlO2-+6H2O=4Al (OH)3↓ |
| C、向AlCl3溶液中投入过量的Na:Na+Al3++2H2O=Na++AlO2-+2H2↑ |
| D、氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
下列有关硫的叙述中,不正确的是( )
| A、粘附在试管壁上的硫可用二硫化碳清洗 |
| B、S2和S8是同素异形体 |
| C、硫在自然界中主要以化合态形式存在 |
| D、硫粉和铜粉混合共热生成黑色的CuS |
下列有关电解质溶液中粒子浓度关系正确的是( )
| A、SO2的水溶液中:c(H+)>c(HSO3-)=2c(SO32-) |
| B、室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| C、室温下,pH=1的NaHSO4溶液:c(SO42-)+c(OH-)=0.1mol |
| D、含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4+)+c(C2O42-)+c(H2C2O4)] |
20℃,已知2g氢气点燃后生成水放热235kJ,下列热化学方程式正确的是( )
A、H2(g)+
| ||
| B、H2(g)+O2(g)=2H2O(1)△H=-235kJ.mol-1 | ||
C、H2(g)+
| ||
| D、H2(g)+O2(g)=H2O(1)△H=-470kJ.mol-1 |
用标准盐酸滴定未知浓度的NaOH溶液,如果测得结果偏低,则产生误差的原因可能是下列叙述中的( )
| A、滴定过程中,初读数平视,末读数俯视 |
| B、锥形瓶用蒸馏水洗净后,未经干燥即进行滴定 |
| C、酸式滴定管未用标准盐酸润洗 |
| D、滴定前酸式滴定管尖嘴部分有气泡,滴定终止时气泡消失 |
 工业上“固定”和利用CO2能有效地减轻“温室’效应.有一种用CO2生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1
工业上“固定”和利用CO2能有效地减轻“温室’效应.有一种用CO2生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1 现用中和滴定法测定某烧碱溶液的浓度,有关数据记录如下:
现用中和滴定法测定某烧碱溶液的浓度,有关数据记录如下: