题目内容
以NA表示阿伏伽德罗常数,下列有关说法正确的是( )
| A、3.4gNH3中含N-H键数目为0.2NA |
| B、14 g乙烯和丙烯的混合物中总原子数为3NA |
| C、2.24LCO2与足量的Na2O2反应,反应中转移的电子总数为0.1NA |
| D、理论上氢氧燃料电池正极消耗11.2 L标准状况下气体时,外电路通过电子数为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、质量换算物质的量结合氨气分子结构分析计算;
B、乙烯和丙烯的最简式相同,都为CH2,以此计算;
C、二氧化碳所处的状态不明确;
D、依据氢氧燃料电池的原电池原理结合电极反应计算电子转移数.
B、乙烯和丙烯的最简式相同,都为CH2,以此计算;
C、二氧化碳所处的状态不明确;
D、依据氢氧燃料电池的原电池原理结合电极反应计算电子转移数.
解答:
解:A、3.4gNH3 物质的量n=
=0.2mol,含N-H键数目为0.6NA,故A错误;
B、乙烯和丙烯的最简式相同,都为CH2,14g乙烯和丙烯的混合物中总原子数为
3NA/mol=3NA,故B正确;
C、二氧化碳所处的状态不明确,不一定是标况,故2.24L二氧化碳的物质的量不一定是0.1mol,故C错误;
D、电池中电子守恒,氢氧燃料电池的正极反应为O2+2H2O+4e-=4OH-,消耗11.2L标准状况下气体是0.5molO2,电子转移为2mol,外线路通过电子数为2NA,故D错误;
故选B.
| 3.4g |
| 17g/mol |
B、乙烯和丙烯的最简式相同,都为CH2,14g乙烯和丙烯的混合物中总原子数为
| 14g |
| 14g/mol |
C、二氧化碳所处的状态不明确,不一定是标况,故2.24L二氧化碳的物质的量不一定是0.1mol,故C错误;
D、电池中电子守恒,氢氧燃料电池的正极反应为O2+2H2O+4e-=4OH-,消耗11.2L标准状况下气体是0.5molO2,电子转移为2mol,外线路通过电子数为2NA,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
分类法是化学研究的重要方法,对下列物质的分类,正确的是( )
A、同分异构体: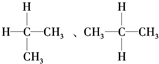 |
B、烷烃:CH4、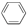 、CH2═CH2 、CH2═CH2 |
| C、糖类:葡萄糖、蔗糖、纤维素 |
| D、酸:乙酸、硫酸、油脂 |
短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同.X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子.根据以上叙述,下列说中正确的是( )
| A、W、X、Y、Z原子的核外最外层电子数的总和为20 |
| B、上述W、X、Y元素的原子半径大小为W<X<Y |
| C、由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
| D、W与Y可形成既含极性共价键又含非极性共价键的化合物 |
同温同压下,两个相同容积的容器中,一个盛有NO气体,另一个盛有N2和O2的混合气体,则两容器内的气体一定具有相同的( )
①分子数②原子数③质子数④质量⑤密度⑥物质的量.
①分子数②原子数③质子数④质量⑤密度⑥物质的量.
| A、①② | B、②③⑤ |
| C、②③⑥ | D、①②⑥ |
下列离子方程式正确的是( )
| A、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| B、向AlCl3溶液中加入NaAlO2:Al3++3AlO2-+6H2O=4Al (OH)3↓ |
| C、向AlCl3溶液中投入过量的Na:Na+Al3++2H2O=Na++AlO2-+2H2↑ |
| D、氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
 现用中和滴定法测定某烧碱溶液的浓度,有关数据记录如下:
现用中和滴定法测定某烧碱溶液的浓度,有关数据记录如下: DEET在一定条件下,可通过下面的路线来合成:
DEET在一定条件下,可通过下面的路线来合成: