题目内容
1.某酸性废液含有H+、Fe3+、Ni2+、NO3-、F─和Cr2O72─等.图是该废液的综合利用工艺流程:(假设:F─与金属离子的络合反应不影响其他反应和计算)
已知:
①金属离子开始沉淀和沉淀完全时的pH:
| Fe3+ | Ni2+ | Cr3+ | |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
(1)滤渣1的主要成份为:Fe(OH)3.
(2)请写出“转化”时NaHSO3与Cr2O72─发生反应的离子方程式Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O.
(3)试剂X可以是足量氨水,还可以是:BC.A.NaOH B.Ni(OH)2 C.NiO D.Fe2O3
(4)写出Cr(OH)3在水中的电离方程式Cr(OH)3?Cr3++3OH-,Cr(OH)3+H2O?[Cr(OH)4]-+H+.
(5)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:[Ni(NH3)6]2++S2-=NiS↓+6NH3.
(6)请写出Cr3+与酸性高锰酸钾发生反应的离子方程式10Cr3++6MnO4-+11H2O=6Mn2++5Cr2O72-+22H+.
(7)经检测,最后的残液中c(Ca2+)=1.0×10─5 mol•L-1,则残液中F-浓度为38mg•L-1,
不符合(填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10─11,国家排放标准要求氟离子浓度小于10mg•L-1].
分析 某酸性废液含有H+、Fe3+、Ni2+、NO3-、F─和Cr2O72─等,在溶液中加入废氧化铁调节溶液PH=3.5,使铁离子全部沉淀,过滤得到滤渣Ⅰ,滤液中加入NaHSO3与Cr2O72-发生反应收藏铬离子,加入足量氨水沉淀铬离子形成氢氧化铬沉淀,过滤后的滤液中加入Na2S沉淀镍,过滤得到滤液中加入石灰浆沉淀得到滤渣3CaF2、Ca(OH)2和CaSO4,
(1)在溶液中加入废氧化铁调节溶液PH=3.5,使铁离子全部沉淀,过滤得到滤渣Ⅰ;
(2)转化时NaHSO3与Cr2O72-发生氧化还原,反应生成铬离子=硫酸根离子和水;
(3)据金属离子开始沉淀和沉淀完全时的pH分析,又不引入新杂质;
(4)先判断电解质的强弱,强电解质完全电离用“═”,弱电解质部分电离用可逆号,电离方程式应遵循质量守恒定律和电荷守恒,并注意原子团不可拆分;
(5)Ni2+与足量氨水的反应为:Ni2++6NH3?[Ni(NH3)6]2+,加入Na2S会生成更难溶的NiS;
(6)在一定条件下,Cr3+与酸性高锰酸钾发生反应,产物是Cr2O72-和Mn2+;
(7)依据溶度积常数计算F-离子浓度,依据国家排放标准要求氟离子浓度小于10mg•L-1分析判断.
解答 解:(1)调节溶液PH=3.5,使铁离子全部沉淀,滤渣Ⅰ为Fe(OH)3,
故答案为:Fe(OH)3;
(2)转化时NaHSO3与Cr2O72-发生氧化还原,反应生成铬离子、硫酸根离子和水,反应的离子方程式为:Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O,
故答案为:Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O;
(3)据金属离子开始沉淀和沉淀完全时的pH分析,又不引入新杂质可知还可以是Ni(OH)2、NiO,
故答案为:BC;
(4)Cr(OH)3为弱电解质,在水中部分电离,电离方程式为:Cr(OH)3?Cr3++3OH-,Cr(OH)3+H2O?[Cr(OH)4]-+H+,
故答案为:Cr(OH)3?Cr3++3OH-;Cr(OH)3+H2O?[Cr(OH)4]-+H+;
(5)Ni2+与足量氨水的反应为:Ni2++6NH3?[Ni(NH3)6]2+,加入Na2S会生成更难溶的NiS,“沉镍”的离子方程式为:[Ni(NH3)6]2++S2-=NiS↓+6NH3,
故答案为:[Ni(NH3)6]2++S2-=NiS↓+6NH3;
(6)在一定条件下,Cr3+与酸性高锰酸钾发生反应,产物是Cr2O72-和Mn2+,所发生的离子反应方程式为10Cr3++6MnO4-+11H2O=6Mn2++5Cr2O72-+22 H+,
故答案为:10Cr3++6MnO4-+11H2O=6Mn2++5Cr2O72-+22 H+;
(7)依据溶度积常数计算F-离子浓度,Ksp=c(Ca2+)c(F-)2=4×10-11 mol3•L-3,残液中c(Ca2+)=1.0×10─5mol•L-1,则c(F-)=$\frac{4×1{0}^{-11}}{1.0×1{0}^{-5}}$=2×10-3mol/L=2×10-3mol/L×19g/mol=38×10-3g/L=38mg/L,依据国家排放标准要求氟离子浓度大于10mg•L-1分析判断,不符合国家标准,
故答案为:38,不符合.
点评 本题考查了物质的分离和提纯方法分析、实验基本操作的理解应用,主要是离子分离方法和条件的判断,掌握基础是解题关键,题目难度中等.

| A. | Y、Z、W的简单离子半径Z>W>Y | B. | 工业上制取Y可用电解YW3制得 | ||
| C. | XW2中各原子均达到8电子结构 | D. | Z、W的氧化物对应水化物的酸性Z<W |
| X | Y | Z | 目的 | 装置 | |
| A | 甲苯 | KMnO4溶液 | 稀硫酸 | 证明甲基对苯环的性质存在影响 | 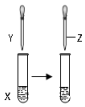 |
| B | FeCl3溶液 | KSCN溶液 | 饱和KCl溶液 | 证明增大反应物浓度化学平衡向正反应方向移动 | |
| C | 1mol/LNaOH 溶液5mL | 1-氯丁烷5mL | 2%AgNO3 溶液1mL | 证明1-氯丁烷中含有氯元素 | |
| D | 0.1mol/LNaCl 溶液2mL | 0.1mol/LAgNO3溶液1mL | 0.1mol/LNa2S 溶液1mL | 证明AgCl大于Ag2S的溶解度 |
| A. | A | B. | B | C. | C | D. | D |

下列说法正确的是( )
| A. | 原料甲与苯酚互为同系物 | |
| B. | 中间产物乙、丙和多巴胺都具有两性 | |
| C. | 多巴胺不可能存在氨基酸类的同分异构体 | |
| D. | 1 mol甲最多可以和2 mol Br2发生取代反应 |
| A. | X的氢化物中仅含有极性键 | |
| B. | X与Y形成的三原子分子的电子式是 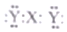 | |
| C. | 原子半径Z>Y,离子半径Z2+<Y2- | |
| D. | X、Y的非金属性强弱可用其氧化物的水化物的酸性强弱来推断 |
| A. | 升高温度 | B. | 改用50mL2mol/L盐酸 | ||
| C. | 改用200mL1mol/L盐酸 | D. | 用等量铁粉代替铁片 |
| A. | 用KIO3 氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | 向Ca(ClO)2溶液中通入过量CO2制次氯酸:ClO-+H2O+CO2═HClO+HCO3- | |
| C. | 向酸性KMnO 4溶液中滴入H 2O2:2MnO 4-+6H++3H2O2═2Mn 2++4O2↑+6H2O | |
| D. | 用Cl2与石灰乳反应制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O |