题目内容
11.下列反应的离子方程式正确的是( )| A. | 用KIO3 氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | 向Ca(ClO)2溶液中通入过量CO2制次氯酸:ClO-+H2O+CO2═HClO+HCO3- | |
| C. | 向酸性KMnO 4溶液中滴入H 2O2:2MnO 4-+6H++3H2O2═2Mn 2++4O2↑+6H2O | |
| D. | 用Cl2与石灰乳反应制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O |
分析 A.酸性条件下反应产物中不会存在氢氧根离子;
B.二氧化碳过量,反应生成次氯酸和碳酸氢钙;
C.2mol高锰酸根离子反应转移10mol电子,根据电子守恒应该生成5mol氧气;
D.石灰乳中的氢氧化钙不能拆开.
解答 解:A.用KIO3 氧化酸性溶液中的KI,二者发生氧化还原反应,正确的离子方程式为:5I-+IO3-+6H++═3I2+3H2O,故A错误;
B.向Ca(ClO)2溶液中通入过量CO 2制次氯酸,反应生成次氯酸和碳酸氢钙,反应的离子方程式为:ClO-+H2O+CO2═HClO+HCO3-,故B正确;
C.向酸性KMnO 4溶液中滴入H2O2,二者发生氧化还原反应,正确的离子方程式为::2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O,故C错误;
D.氢氧化钙不能拆开,正确的离子方程式为:Cl2+Ca(OH)2═Ca2++Cl-+ClO-+H2O,故D错误;
故选B.
点评 本题考查了离子方程式的判断,题目难度不大,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
相关题目
1.某酸性废液含有H+、Fe3+、Ni2+、NO3-、F─和Cr2O72─等.图是该废液的综合利用工艺流程:(假设:F─与金属离子的络合反应不影响其他反应和计算)

已知:
①金属离子开始沉淀和沉淀完全时的pH:
②Ni2+与足量氨水的反应为:Ni2++6NH3?[Ni(NH3)6]2+
(1)滤渣1的主要成份为:Fe(OH)3.
(2)请写出“转化”时NaHSO3与Cr2O72─发生反应的离子方程式Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O.
(3)试剂X可以是足量氨水,还可以是:BC.A.NaOH B.Ni(OH)2 C.NiO D.Fe2O3
(4)写出Cr(OH)3在水中的电离方程式Cr(OH)3?Cr3++3OH-,Cr(OH)3+H2O?[Cr(OH)4]-+H+.
(5)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:[Ni(NH3)6]2++S2-=NiS↓+6NH3.
(6)请写出Cr3+与酸性高锰酸钾发生反应的离子方程式10Cr3++6MnO4-+11H2O=6Mn2++5Cr2O72-+22H+.
(7)经检测,最后的残液中c(Ca2+)=1.0×10─5 mol•L-1,则残液中F-浓度为38mg•L-1,
不符合(填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10─11,国家排放标准要求氟离子浓度小于10mg•L-1].

已知:
①金属离子开始沉淀和沉淀完全时的pH:
| Fe3+ | Ni2+ | Cr3+ | |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
(1)滤渣1的主要成份为:Fe(OH)3.
(2)请写出“转化”时NaHSO3与Cr2O72─发生反应的离子方程式Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O.
(3)试剂X可以是足量氨水,还可以是:BC.A.NaOH B.Ni(OH)2 C.NiO D.Fe2O3
(4)写出Cr(OH)3在水中的电离方程式Cr(OH)3?Cr3++3OH-,Cr(OH)3+H2O?[Cr(OH)4]-+H+.
(5)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:[Ni(NH3)6]2++S2-=NiS↓+6NH3.
(6)请写出Cr3+与酸性高锰酸钾发生反应的离子方程式10Cr3++6MnO4-+11H2O=6Mn2++5Cr2O72-+22H+.
(7)经检测,最后的残液中c(Ca2+)=1.0×10─5 mol•L-1,则残液中F-浓度为38mg•L-1,
不符合(填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10─11,国家排放标准要求氟离子浓度小于10mg•L-1].
2.下列说法不正确的是( )
| A. | 12C与14C为不同核素 | B. | 石墨和C60互为同素异形体 | ||
| C. | O2和O3互为同位素 | D. | ${\;}_{17}^{35}$X与${\;}_{17}^{37}$Y 为同种元素 |
19.下列有关化学用语表示正确的是( )
| A. | Mg原子的结构示意图: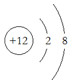 | B. | OCl2分子的电子式: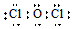 | ||
| C. | HF分子的电子式: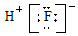 | D. | Na2S形成的电子式 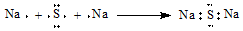 |
6.如图为冰的一种骨架形式,依此为单位向空间延伸,请问该冰中的每个水分子有几个氢键( )
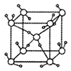

| A. | 2 | B. | 4 | C. | 8 | D. | 1 |
16.下列物质互为同分异构体的一组是( )
| A. | 白磷和红磷 | B. | 甲烷和丙烷 | ||
| C. | 1H和2H | D. | CH3CH2OH和CH3OCH3 |
3.在N2+3H2?2NH3的可逆反应中,自反应开始至2s末,氨的浓度由0变为0.8 mol•L-1 则以氢气的浓度变化表示该反应在2s内的平均反应速率是( )
| A. | 0.3 mol•L-1•S-1 | B. | 0.4 mol•L-1•S-1 | C. | 0.6mol•L-1•S-1 | D. | 0.8 mol•L-1•S-1 |
20.中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝.关于${\;}_{116}^{203}$Lv的叙述错误的是( )
| A. | 原子序数116 | B. | 中子数177 | C. | 核外电子数116 | D. | 质子数177 |
16.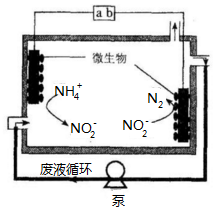 微生物电解法可用于处理废水.其工作原理如图所示,下列说法正确的是( )
微生物电解法可用于处理废水.其工作原理如图所示,下列说法正确的是( )
 微生物电解法可用于处理废水.其工作原理如图所示,下列说法正确的是( )
微生物电解法可用于处理废水.其工作原理如图所示,下列说法正确的是( )| A. | a为电源的负极 | |
| B. | 右侧电极反应式为:2NO2-+6e-+4 H+=N2↑+4OH- | |
| C. | 电池工作一段时间后,溶液中NO2-的浓度不变 | |
| D. | 每通过3mol电子,最多处理0.5mol NH4+ |