题目内容
16.用如图所示装置进行以下实验,能达到实验目的是( )| X | Y | Z | 目的 | 装置 | |
| A | 甲苯 | KMnO4溶液 | 稀硫酸 | 证明甲基对苯环的性质存在影响 | 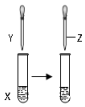 |
| B | FeCl3溶液 | KSCN溶液 | 饱和KCl溶液 | 证明增大反应物浓度化学平衡向正反应方向移动 | |
| C | 1mol/LNaOH 溶液5mL | 1-氯丁烷5mL | 2%AgNO3 溶液1mL | 证明1-氯丁烷中含有氯元素 | |
| D | 0.1mol/LNaCl 溶液2mL | 0.1mol/LAgNO3溶液1mL | 0.1mol/LNa2S 溶液1mL | 证明AgCl大于Ag2S的溶解度 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.苯环影响甲基,被高锰酸钾氧化生成苯甲酸;
B.KCl对络合反应无影响;
C.水解后检验卤素离子,应在酸性条件下;
D.生成AgCl转化为硫化银,为沉淀的转化.
解答 解:A.苯环影响甲基,被高锰酸钾氧化生成苯甲酸,不能验证实验目的,故A错误;
B.KCl对络合反应无影响,则不能说明平衡移动,故B错误;
C.水解后检验卤素离子,应在酸性条件下,没有加酸至酸性,不能检验氯离子,故C错误;
D.生成AgCl转化为硫化银,为沉淀的转化,可证明AgCl大于Ag2S的溶解度,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握有机物的性质、化学平衡、离子检验、沉淀转化为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
2.化学与社会、生产、生活密切相关,下列说法错误的是( )
| A. | 利用风能、太阳能等清洁能源代替化石燃料,可减少环境污染 | |
| B. | 煤的干馏、煤的汽化和煤的液化都属于化学变化 | |
| C. | 自来水厂用明矾净水,用Fe2(SO4)3或ClO2代替明矾净水,其原理相同 | |
| D. | 将水中的铁闸门连接电源的负极而防腐,是外加电流的阴极保护法 |
11.下列关于有机化合物的说法正确的是( )
| A. | 1mol的  与足量的NaOH溶液反应,能消耗3mol NaOH 与足量的NaOH溶液反应,能消耗3mol NaOH | |
| B. | 可用氢氧化钠溶液除去乙酸乙酯中残留的乙酸 | |
| C. | 间二甲苯也叫1,5-二甲苯 | |
| D. | 乙二醇和丙三醇互为同系物 |
1.某酸性废液含有H+、Fe3+、Ni2+、NO3-、F─和Cr2O72─等.图是该废液的综合利用工艺流程:(假设:F─与金属离子的络合反应不影响其他反应和计算)

已知:
①金属离子开始沉淀和沉淀完全时的pH:
②Ni2+与足量氨水的反应为:Ni2++6NH3?[Ni(NH3)6]2+
(1)滤渣1的主要成份为:Fe(OH)3.
(2)请写出“转化”时NaHSO3与Cr2O72─发生反应的离子方程式Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O.
(3)试剂X可以是足量氨水,还可以是:BC.A.NaOH B.Ni(OH)2 C.NiO D.Fe2O3
(4)写出Cr(OH)3在水中的电离方程式Cr(OH)3?Cr3++3OH-,Cr(OH)3+H2O?[Cr(OH)4]-+H+.
(5)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:[Ni(NH3)6]2++S2-=NiS↓+6NH3.
(6)请写出Cr3+与酸性高锰酸钾发生反应的离子方程式10Cr3++6MnO4-+11H2O=6Mn2++5Cr2O72-+22H+.
(7)经检测,最后的残液中c(Ca2+)=1.0×10─5 mol•L-1,则残液中F-浓度为38mg•L-1,
不符合(填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10─11,国家排放标准要求氟离子浓度小于10mg•L-1].

已知:
①金属离子开始沉淀和沉淀完全时的pH:
| Fe3+ | Ni2+ | Cr3+ | |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
(1)滤渣1的主要成份为:Fe(OH)3.
(2)请写出“转化”时NaHSO3与Cr2O72─发生反应的离子方程式Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O.
(3)试剂X可以是足量氨水,还可以是:BC.A.NaOH B.Ni(OH)2 C.NiO D.Fe2O3
(4)写出Cr(OH)3在水中的电离方程式Cr(OH)3?Cr3++3OH-,Cr(OH)3+H2O?[Cr(OH)4]-+H+.
(5)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:[Ni(NH3)6]2++S2-=NiS↓+6NH3.
(6)请写出Cr3+与酸性高锰酸钾发生反应的离子方程式10Cr3++6MnO4-+11H2O=6Mn2++5Cr2O72-+22H+.
(7)经检测,最后的残液中c(Ca2+)=1.0×10─5 mol•L-1,则残液中F-浓度为38mg•L-1,
不符合(填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10─11,国家排放标准要求氟离子浓度小于10mg•L-1].
5.下列反应过程中的能量变化与如图相符的是( )


| A. | 金属钠和水反应 | B. | 生石灰变成熟石灰的反应 | ||
| C. | Al和Fe2O3的铝热反应 | D. | CaCO3受热分解 |
6.如图为冰的一种骨架形式,依此为单位向空间延伸,请问该冰中的每个水分子有几个氢键( )
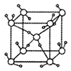

| A. | 2 | B. | 4 | C. | 8 | D. | 1 |
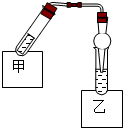 如图是乙酸乙酯制备的装置.在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上.
如图是乙酸乙酯制备的装置.在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上. )是一种定香剂,以芳香醇A为原料合成H的一种流程如图:
)是一种定香剂,以芳香醇A为原料合成H的一种流程如图:
 +H2O(R1、R表示氢原子或烃基)
+H2O(R1、R表示氢原子或烃基) ;H的官能团名称是碳碳双键、酯基.
;H的官能团名称是碳碳双键、酯基. .
. (写一种即可).
(写一种即可).