题目内容
12.低碳原子数的烷烃(如C3H8)和烯烃(如C3H6)是用途广泛的工业原料,也是优良的工业燃料;C3H8与C3H6之间可以相互转化.回答下列问题:(1)已知:C3H8(g)=CH4(g)+HC≡CH(g)+H2(g)△H=+156.6kJ/mol CH3CH=CH2(g)=CH4(g)+HC≡CH(g)△H=+32.4kJ/mol
在相同条件下,反应 C3H8(g)=CH3CH=CH2(g)+H2(g)的△H=+124.2KJ/mol
(2)以C3H8为原料制作的燃料电池,在电池的正极区通入CO2和O2,负极区通入 C3H8,以某种熔融碳酸盐作电解质.该电池发生的总反应的反应方程式为C3H8+5O2═3CO2+4H2O ,电池工作时,CO32-向负极区域移动.
(3 )C3H6燃烧生成的CO2是生产NaHCO3的重要原料.实验测得,常温下饱和NaHCO3溶液的pH>8,请说明其原因(用离子方程式表示)HCO3-+H2O?H2CO3+OH-;溶液中c(H2CO3)>c(CO32-)(用“>”、“<”或“=”表示).
分析 (1)依据已知化学方程式构建目标方程式,根据盖斯定律计算得到△H;
(2)以C3H8为原料制作的燃料电池,负极通入丙烷,碳元素的化合价升高,电池的正极通入O2,氧元素的化合价降低,以此来书写电池总反应方程式,原电池中阴离子向负极移动;
(3)常温下,NaHCO3溶液的pH大于8,说明溶液中HCO3-水解程度大于电离程度导致溶液呈碱性,根据NaHCO3溶液的中HCO3-的水解程度大于自身的电离程度来回答c(H2CO3)、c(CO32-)相对大小.
解答 解:(1)已知①C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJ/mol
②CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=32.4kJ/mol
依据盖斯定律①-②得到C3H8(g)→CH3CH=CH2(g)+H2(g)△H=(156.6kJ/mol )-(32.4kJ/mol)=+124.2KJ/mol,
故答案为:+124.2KJ/mol;
(2)以C3H8为原料制作的燃料电池,负极通入丙烷,碳元素的化合价升高,电池的正极通入O2,氧元素的化合价降低,即丙烷与氧气反应生成二氧化碳和水,则电池的总反应为C3H8+5O2═3CO2+4H2O,原电池中阴离子向负极移动,即CO32-移向电池的负极,
故答案为:C3H8+5O2═3CO2+4H2O;负;
(3)常温下,NaHCO3溶液的pH大于8,说明溶液中HCO3-水解程度大于电离程度导致溶液呈碱性,水解平衡为HCO3-+H2O?H2CO3+OH-,因NaHCO3溶液显碱性,HCO3-的水解程度大于自身的电离程度,即NaHCO3溶液中既存在电离平衡为HCO3-?CO32-+H+,水解平衡为HCO3-+H2O?H2CO3+OH-,而HCO3-水解程度大于电离程度,所以c(H2CO3)>c(CO32-),
故答案为:HCO3-+H2O?H2CO3+OH-;>.
点评 本题考查了反应热的计算、燃料电池的工作原理、盐类水解的分析,为高频考点,明确溶质性质是解本题关键,易错点是比较c(H2CO3)、c(CO32-)相对大小,侧重考查学生分析判断能力,题目难度中等.

| A. | H2O2的电子式: | B. | CCl4的电子式: | ||
| C. | ${\;}_{\;}^{18}$O的原子结构示意图: | D. | MgCl2的电子式: |
| 选项 | 实验目的 | 所选主要仪器(铁架台等忽略) | 部分操作 |
| A | 用浓硫酸配制480mL0.1mol/L硫酸溶液 | 500mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管 | 将量取好的浓硫酸放入容量瓶中,加水溶解至刻度线 |
| B | 从食盐水中得到NaCl晶体 | 坩埚、酒精灯、玻璃棒、泥三角、三脚架 | 当加热至大量固体出现时,停止加热,利用余热加热 |
| C | 分离甲醇和甘油的混合物 | 蒸馏烧瓶、酒精灯、温度计、直形冷凝管、锥形瓶、牛角管 | 温度计水银球插入液液面以下 |
| D | 用CCl4萃取溴水中的Br2 | 分液漏斗、烧杯 | 分离时下层液体从分液漏斗下口放出,上层液体从上口倒出 |
| A. | A | B. | B | C. | C | D. | D |

| A. | 无论是否鼓入空气,负极的电极反应式均为Fe-2e-═Fe2+ | |
| B. | 不鼓入空气时,正极的电极反应式为H++e-═H | |
| C. | 鼓入空气时,每生成1mol•OH有2mol电子发生转移 | |
| D. | 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气 |

已知:
①金属离子开始沉淀和沉淀完全时的pH:
| Fe3+ | Ni2+ | Cr3+ | |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
(1)滤渣1的主要成份为:Fe(OH)3.
(2)请写出“转化”时NaHSO3与Cr2O72─发生反应的离子方程式Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O.
(3)试剂X可以是足量氨水,还可以是:BC.A.NaOH B.Ni(OH)2 C.NiO D.Fe2O3
(4)写出Cr(OH)3在水中的电离方程式Cr(OH)3?Cr3++3OH-,Cr(OH)3+H2O?[Cr(OH)4]-+H+.
(5)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:[Ni(NH3)6]2++S2-=NiS↓+6NH3.
(6)请写出Cr3+与酸性高锰酸钾发生反应的离子方程式10Cr3++6MnO4-+11H2O=6Mn2++5Cr2O72-+22H+.
(7)经检测,最后的残液中c(Ca2+)=1.0×10─5 mol•L-1,则残液中F-浓度为38mg•L-1,
不符合(填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10─11,国家排放标准要求氟离子浓度小于10mg•L-1].
| A. | 12C与14C为不同核素 | B. | 石墨和C60互为同素异形体 | ||
| C. | O2和O3互为同位素 | D. | ${\;}_{17}^{35}$X与${\;}_{17}^{37}$Y 为同种元素 |
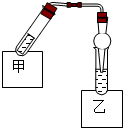 如图是乙酸乙酯制备的装置.在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上.
如图是乙酸乙酯制备的装置.在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上.