题目内容
10.氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答下列问题:(1)把氯气缓慢通入紫色石蕊溶液中,可以观察到的现象是溶液先变红色后褪色.
(2)某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液.
①其反应原理为:(用离子方程式表示)Cl2+2OH-=Cl-+ClO-+H2O.
②实验室配制好4.0mol•L-1的NaOH溶液,这种溶液50mL才能与2.24L氯气(标准状况)恰好完全反应.
(3)配制250mL 4.0mol•L-1 NaOH溶液的实验步骤:
a.计算需要氢氧化钠固体的质量
b.称量氢氧化钠固体
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶.
d.用适量蒸馏水溶解称量好的氢氧化钠固体,静置冷却.
e.盖好瓶塞,反复上下颠倒,摇匀.
f.继续向容量瓶中加蒸馏水至刻度线下1cm~2cm时,改用胶头滴管加蒸馏水至凹液面与刻度线相切.
①用天平称量的所需氢氧化钠固体的质量是40g.
②上述步骤的正确操作顺序a、b、d、c、f、e.
(4)某化学实验小组的同学为了证明、比较SO2和氯水的漂白性,设计了如图1所示的实验装置.

①实验室常选用制CO2的发生装置,用KMnO4和浓盐酸制Cl2;选用Cu和浓硫酸反应制取SO2时,应选用上图A、E两发生装置中E装置(填装置序号),反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,.
②反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为B:无变化,
D:恢复红色.
(5)化学实验小组的同学还利用图2所示装置探究SO2和Cl2按不同比例混合后的漂白性.
试分析:
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是:a.控制气体通入速率;b.使SO2和Cl2充分混合.
②实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是SO2+Cl2+2H2O=2HCl+H2SO4(用化学方程式表示).
分析 (1)氯气和水反应生成盐酸和次氯酸,次氯酸有漂白性,紫色石蕊试液遇酸变蓝色;
(2)①氯气和氢氧根离子反应生成氯离子、次氯酸根离子和水;
②由Cl2+2NaOH=NaCl+NaClO+H2O及物质的量计算解答;
(3)结合m=cVM计算质量,配制溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀、装瓶等,结合步骤分析使用的仪器;
(4)①Cu和浓硫酸反应制取SO2时,需加热才能发生;②根据二氧化硫的漂白性是可逆的,而氯水的漂白性是不可逆的进行解答;
(5)①氯气和二氧化硫在该装置中能充分混合,且通过观察气泡的速度控制气体流量,使二者按一定比列混合;
②氯气和二氧化硫在水溶液中恰好发生氧化还原反应,转化成没有漂白性的盐酸和硫酸;
解答 解:(1)氯气和水反应生成盐酸和次氯酸,溶液中含有酸,紫色石蕊试液遇酸变红色,所以溶液呈现红色,但次氯酸有漂白性,所以溶液立即褪色,故答案为:溶液先变红色后褪色;
(2)氯气和氢氧根离子反应生成氯离子、次氯酸根离子和水,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
n(Cl2)=$\frac{2.24L}{22.4L•mo{l}^{-1}}$=0.1mol
由Cl2+2NaOH=NaCl+NaClO+H2O
知n(NaOH)=2n(Cl2)=2×0.1mol=0.2mol
V(NaOH溶液)=$\frac{0.2mol}{4.0mol•{L}^{-1}}$=0.05L,
故答案为:50ml;
(3)①n(NaOH)=0.25L×4.0mol•L-1=1.0mol,m(NaOH)=1.0mol×40g•mol-1=40g,故答案为:40g;
②配制溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀、装瓶等,则正确的顺序为a、b、d、c、f、e,故答案为:a、b、d、c、f、e;
(4)①Cu和浓硫酸反应制取SO2时,需加热才能发生,反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,故答案为:E;Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
②SO2使品红褪色,生成不稳定的无色物质,可以看作是一个化合反应.该生成的无色物质不很稳定,受热又能分解放出SO2,而恢复原来的红色.氯气使品红褪色是氧化性漂白,不可还原,无法恢复,
故答案为:无变化;恢复红色;
(5)①氯气和二氧化硫在该装置中能充分混合,且通过观察气泡的速度控制气体流量,使二者按一定比列混合,故答案为:使SO2和Cl2充分混合;
②氯气和二氧化硫在水溶液中恰好发生氧化还原反应,转化成没有漂白性的盐酸和硫酸,反应方程式为:SO2+Cl2+2H2O=2HCl+H2SO4,故答案为:SO2+Cl2+2H2O=2HCl+H2SO4.
点评 本题考查氯气的性质及溶液的配制,把握发生的化学反应及溶液配制的步骤为解答的关键,注重基础知识的考查,题目难度不大.

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案| A. | 在0℃、1.01×105 Pa的条件下,某气体的体积约为2.24×10-2 m3,该气体的物质的量为1 mol | |
| B. | 1 mol某气体的体积为22.4 L,该气体所处的状况必定为标准状况 | |
| C. | 在20℃的温度下,1 mol某气体的体积约为22.4 L,该气体的压强为101 kPa | |
| D. | 固态的二氧化碳又叫干冰,含CO2 1 mol的干冰在标准状况下的体积必定小于22.4 L |
| A. | SiO2(s)+2C(s)═Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0 | |
| B. | 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | C(s)+H2O(g)?CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |

| A. | 该过程中CeO2做催化剂 | |
| B. | 该过程实现了太阳能与化学能的相互转化 | |
| C. | 图中△H1+△H2+△H3﹦0 | |
| D. | 以CO和O2构成的碱性燃料电池的负极反应式为:CO+4OH--2e-═CO32-+2H2O |
①向硅酸钠溶液中通入过量的CO2②向Fe(OH)3胶体中逐滴加入过量的稀盐酸
③向NaAlO2溶液中通入过量的CO2 ④向澄清石灰水中通入缓慢过量的CO2.
| A. | ①② | B. | ①③ | C. | ①④ | D. | ②③ |
| A. | 氯气和液氯是两种不同的物质 | |
| B. | Cl2通入到含有酚酞的NaOH溶液中红色褪去,因为氯气有漂白性 | |
| C. | Cl2在化学反应中既能作氧化剂,又能作还原剂 | |
| D. | 新制的氯水呈酸性,向其中滴加几滴紫色石蕊试液并振荡,溶液呈红色 |
| A. | 标准状况下1molH2O | |
| B. | 20℃、101kPa时36.5gHCl | |
| C. | 常温常压下17gNH3 | |
| D. | 标准状况下0.4mol H2和0.6molO2的混合气 |
| A. | 在NaHCO3溶液中一定有c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) | |
| B. | 在等体积、等物质的量浓度的Na2CO3和NaHCO3两溶液中,阳离子总数相等 | |
| C. | 在Na2CO3和NaHCO3两溶液中,离子种类不相同 | |
| D. | 在NaHCO3溶液中一定有c(Na+)>c(CO32-)>c(H+)>c(OH-) |
 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.(1)工业上可通过CO和H2化合来制备甲醇.已知某些化学键的键能数据如表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(2)工业上由甲醇制取甲醛的两种方法如下(有关数据均为在298K时测定):
反应Ⅰ:CH3OH(g)═HCHO(g)+H2(g)△H1=+92.09kJ/mol,K1=3.92×10-11
反应Ⅱ:CH3OH(g)+$\frac{1}{2}$O2(g)═HCHO(g)+H2O(g)△H2=-149.73kJ/mol,K2=4.35×1029
从原子利用率看,反应Ⅰ(填“Ⅰ”或“Ⅱ”.下同)制甲醛的原子利用率更高.从反应的焓变和平衡常数K值看,反应Ⅱ制甲醛更有利.
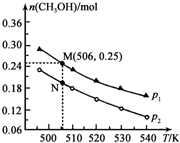
(3)工业废气二氧化碳催化加氢也可合成甲醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H.在密闭容器中投入1molCO2和2.75molH2,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示.
①二氧化碳合成甲醇正反应的△H<0 (填“>”、“<”或“=”,下同).
②M、N两点时化学反应速率:v(N)<v(M).
③为提高CO2的转化率除可改变温度和压强外,还可采取的措施是增大氢碳比.
④图中M点时,容器体积为10L,则N点对应的平衡常数K=1.04(填数值,保留2位小数).
(4)一定条件下,向容积不变的某密闭容器中加入a molCO2和b molH2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),欲使整个反应过程中CO2的体积分数为恒定值,则a与b的关系是a=b.