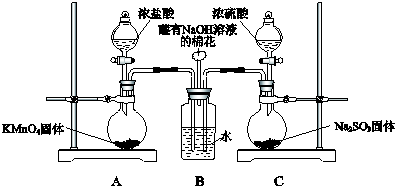
题目内容
14. 按如图装置进行实验,并回答下列问题
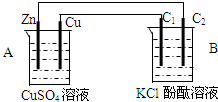
按如图装置进行实验,并回答下列问题(1)判断装置的名称:A池为原电池B池为电解池
(2)铜极为正极,电极反应式为Cu2++2e-→Cu
(3)B装置中,C1与C2均为石墨棒,石墨棒C1为阳极,电极反应式为2Cl--2e-→Cl2↑,石墨棒C2附近发生的实验现象为电极上有气泡产生,无色溶液变红色
(4)当C2极析出224mL(标准状态)气体时,锌的质量减少0.65g.
分析 (1)有外加电源的是电解池,没有外加电源的是原电池或者根据原电池和电解池的构成条件来回答;
(2)原电池中活泼金属锌是负极,金属铜是正极,正极上是电解质里的阳离子得电子的还原反应;
(3)石墨棒C2和原电池的负极相连,氢离子得电子发生还原反应,石墨棒C1和原电池的正极相连,是阳极,该电极上氯离子失电子发生氧化反应,据此回答;
(4)根据电子守恒定律结合电极反应式进行计算回答.
解答 解:(1)装置A符合原电池的构成条件:两个活泼性不同的电极,属于原电池,Zn失电子族负极,装置B符合电解池的构成条件,属于电解池;
故答案为:原电池;电解池;
(2)A中金属锌是负极,金属铜是正极,正极反应是:Cu2++2e-→Cu,故答案为:正;Cu2++2e-→Cu;
(3)石墨棒C2和原电池的负极相连,是阴极,石墨棒C1和原电池的正极相连,是阳极,该电极上氯离子失电子,发生氧化反应:2Cl--2e-→Cl2↑,在阴极上,氢离子放电产生氢气,2H++2e-→H2↑,所以氢离子浓度减小而氢氧根浓度增大,碱性增强,使酚酞变红,
故答案为:阳;电极上有气泡产生,无色溶液变红色;
(4)C2极发生的电极反应为:2H++2e-→H2↑,析出224mL(即0.01mol)气体(标准状态)时,转移电子数是0.02mol,所以锌极转移电子也为0.02mol,根据电极反应:Zn-2e-→Zn2+,消耗金属锌0.01mol,质量是0.01mol×65g/mol=0.65g,故答案为:0.65.
点评 本题考查了原电池和电解池原理的应用,把握原电池和电解池的工作原理以及电子守恒原理,难度不大.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
4. 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
(1)工业上可通过CO和H2化合来制备甲醇.已知某些化学键的键能数据如表:
工业通过CO和H2化合来制备甲醇的热化学方程式为CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1;
(2)工业上由甲醇制取甲醛的两种方法如下(有关数据均为在298K时测定):
反应Ⅰ:CH3OH(g)═HCHO(g)+H2(g)△H1=+92.09kJ/mol,K1=3.92×10-11
反应Ⅱ:CH3OH(g)+$\frac{1}{2}$O2(g)═HCHO(g)+H2O(g)△H2=-149.73kJ/mol,K2=4.35×1029
从原子利用率看,反应Ⅰ(填“Ⅰ”或“Ⅱ”.下同)制甲醛的原子利用率更高.从反应的焓变和平衡常数K值看,反应Ⅱ制甲醛更有利.
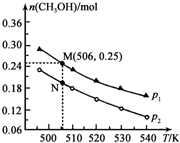
(3)工业废气二氧化碳催化加氢也可合成甲醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H.在密闭容器中投入1molCO2和2.75molH2,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示.
①二氧化碳合成甲醇正反应的△H<0 (填“>”、“<”或“=”,下同).
②M、N两点时化学反应速率:v(N)<v(M).
③为提高CO2的转化率除可改变温度和压强外,还可采取的措施是增大氢碳比.
④图中M点时,容器体积为10L,则N点对应的平衡常数K=1.04(填数值,保留2位小数).
(4)一定条件下,向容积不变的某密闭容器中加入a molCO2和b molH2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),欲使整个反应过程中CO2的体积分数为恒定值,则a与b的关系是a=b.
 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.(1)工业上可通过CO和H2化合来制备甲醇.已知某些化学键的键能数据如表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(2)工业上由甲醇制取甲醛的两种方法如下(有关数据均为在298K时测定):
反应Ⅰ:CH3OH(g)═HCHO(g)+H2(g)△H1=+92.09kJ/mol,K1=3.92×10-11
反应Ⅱ:CH3OH(g)+$\frac{1}{2}$O2(g)═HCHO(g)+H2O(g)△H2=-149.73kJ/mol,K2=4.35×1029
从原子利用率看,反应Ⅰ(填“Ⅰ”或“Ⅱ”.下同)制甲醛的原子利用率更高.从反应的焓变和平衡常数K值看,反应Ⅱ制甲醛更有利.
(3)工业废气二氧化碳催化加氢也可合成甲醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H.在密闭容器中投入1molCO2和2.75molH2,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示.
①二氧化碳合成甲醇正反应的△H<0 (填“>”、“<”或“=”,下同).
②M、N两点时化学反应速率:v(N)<v(M).
③为提高CO2的转化率除可改变温度和压强外,还可采取的措施是增大氢碳比.
④图中M点时,容器体积为10L,则N点对应的平衡常数K=1.04(填数值,保留2位小数).
(4)一定条件下,向容积不变的某密闭容器中加入a molCO2和b molH2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),欲使整个反应过程中CO2的体积分数为恒定值,则a与b的关系是a=b.
2.在一定条件下,Na2CO3溶液中存在如下反应:CO${\;}_{3}^{2-}$+H2O═HCO${\;}_{3}^{-}$+OH-下列说法中正确的是( )
| A. | 溶液中加水,$\frac{c(HC{O}_{3}^{-})•c(O{H}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| B. | 加入Na2CO3固体,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小 | |
| C. | 升高温度,平衡常数减小 | |
| D. | 通入CO2,溶液pH增大 |
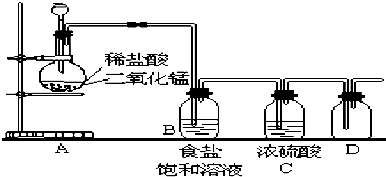
6.某实验兴趣小组按如图装置实验后,所记录内容合理的是( )


| A. | ②③④ | B. | ①②④⑥ | C. | ①②④⑤ | D. | ②③⑤⑥ |
3.下列说法正确( )
| A. | 石油、煤、天然气、油脂都属于化石燃料 | |
| B. | 油脂在碱性条件下的水解反应又称为皂化反应 | |
| C. | 分子式为(C6H10O5)n的淀粉和纤维素互为同分异构 | |
| D. | 蔗糖是还原性糖 |
 某校化学实验兴趣小组为了探究实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),完成下列问题.
某校化学实验兴趣小组为了探究实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),完成下列问题.