题目内容
15.同一短周期的元素W、X、Y、Z的原子序数依次增加,下列叙述正确的是( )| A. | 元素原子得电子能力:W<X<Y<Z | B. | 原子最外层电子数::W<X<Y<Z | ||
| C. | 原子半径:W>X>Y>Z | D. | 元素的最高化合价:W<X<Y<Z |
分析 A.同周期随原子序数增大,主族元素电负性增大,获得电子能力增强,稀有气体电子能力最弱;
B.同周期随原子序数增大,原子最外层电子数增大;
C.同周期随原子序数增大,主族元素原子半径减小,但稀有气体原子半径增大;
D.O元素、F元素没有最高正化合价.
解答 解:A.如Z为零族元素,则Z原子电子能力最弱,故A错误;
B.同周期随原子序数增大,原子最外层电子数依次增大,故B正确;
C.若Z为稀有气体,其原子半径测量方法与主族原子测量方法不同,原子半径比ⅦA族大很多,故C错误;
D.如Z为F元素,没有正价,故D错误,
故选:B.
点评 本题考查同周期元素的性质的递变,题目难度不大,注意元素周期律中特殊性,利用反例法解答.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
5.下列各项操作中,不发生“先产生沉淀,后沉淀溶解”现象的是( )
①向硅酸钠溶液中通入过量的CO2②向Fe(OH)3胶体中逐滴加入过量的稀盐酸
③向NaAlO2溶液中通入过量的CO2 ④向澄清石灰水中通入缓慢过量的CO2.
①向硅酸钠溶液中通入过量的CO2②向Fe(OH)3胶体中逐滴加入过量的稀盐酸
③向NaAlO2溶液中通入过量的CO2 ④向澄清石灰水中通入缓慢过量的CO2.
| A. | ①② | B. | ①③ | C. | ①④ | D. | ②③ |
6.已知某有机物含有4个C,每个碳原子都以键长相等的三条单键连接3个C,且整个结构中所有碳碳键之间的夹角都为60°,则下列说法不正确的是( )
| A. | 该有机物不存在 | B. | 该有机物的分子式为C4H4 | ||
| C. | 该有机物的空间构型为正四面体 | D. | 该有机物不属于笨的同系物 |
10.下列原子间一定形成共价键的是( )
| A. | 两个非金属元素的原子 | B. | 同周期元素的原子 | ||
| C. | 同主族元素的原子 | D. | 活泼金属与活泼非金属的原子 |
4. 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
(1)工业上可通过CO和H2化合来制备甲醇.已知某些化学键的键能数据如表:
工业通过CO和H2化合来制备甲醇的热化学方程式为CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1;
(2)工业上由甲醇制取甲醛的两种方法如下(有关数据均为在298K时测定):
反应Ⅰ:CH3OH(g)═HCHO(g)+H2(g)△H1=+92.09kJ/mol,K1=3.92×10-11
反应Ⅱ:CH3OH(g)+$\frac{1}{2}$O2(g)═HCHO(g)+H2O(g)△H2=-149.73kJ/mol,K2=4.35×1029
从原子利用率看,反应Ⅰ(填“Ⅰ”或“Ⅱ”.下同)制甲醛的原子利用率更高.从反应的焓变和平衡常数K值看,反应Ⅱ制甲醛更有利.
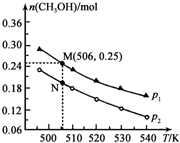
(3)工业废气二氧化碳催化加氢也可合成甲醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H.在密闭容器中投入1molCO2和2.75molH2,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示.
①二氧化碳合成甲醇正反应的△H<0 (填“>”、“<”或“=”,下同).
②M、N两点时化学反应速率:v(N)<v(M).
③为提高CO2的转化率除可改变温度和压强外,还可采取的措施是增大氢碳比.
④图中M点时,容器体积为10L,则N点对应的平衡常数K=1.04(填数值,保留2位小数).
(4)一定条件下,向容积不变的某密闭容器中加入a molCO2和b molH2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),欲使整个反应过程中CO2的体积分数为恒定值,则a与b的关系是a=b.
 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.(1)工业上可通过CO和H2化合来制备甲醇.已知某些化学键的键能数据如表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(2)工业上由甲醇制取甲醛的两种方法如下(有关数据均为在298K时测定):
反应Ⅰ:CH3OH(g)═HCHO(g)+H2(g)△H1=+92.09kJ/mol,K1=3.92×10-11
反应Ⅱ:CH3OH(g)+$\frac{1}{2}$O2(g)═HCHO(g)+H2O(g)△H2=-149.73kJ/mol,K2=4.35×1029
从原子利用率看,反应Ⅰ(填“Ⅰ”或“Ⅱ”.下同)制甲醛的原子利用率更高.从反应的焓变和平衡常数K值看,反应Ⅱ制甲醛更有利.
(3)工业废气二氧化碳催化加氢也可合成甲醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H.在密闭容器中投入1molCO2和2.75molH2,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示.
①二氧化碳合成甲醇正反应的△H<0 (填“>”、“<”或“=”,下同).
②M、N两点时化学反应速率:v(N)<v(M).
③为提高CO2的转化率除可改变温度和压强外,还可采取的措施是增大氢碳比.
④图中M点时,容器体积为10L,则N点对应的平衡常数K=1.04(填数值,保留2位小数).
(4)一定条件下,向容积不变的某密闭容器中加入a molCO2和b molH2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),欲使整个反应过程中CO2的体积分数为恒定值,则a与b的关系是a=b.
8.氢气用于烟气的脱氮、脱硫的反应 4H2(g)+2NO(g)+SO2(g)?N2(g)+S(l)+4H2O(g)△H<0.下列有关说法正确的是( )
| A. | 当v(H2)=v(H2O)时,达到平衡 | |
| B. | 升高温度,正反应速率减小,逆反应速率增大,化学平衡逆向移动 | |
| C. | 使用高效催化剂可提高NO的平衡转化率 | |
| D. | 化学平衡常数表达式为K=$\frac{c({N}_{2})•{c}^{4}({H}_{2}O)}{c(S{O}_{2})•{c}^{2}(NO)•{c}^{4}({H}_{2})}$ |