题目内容
11.关于下图的说法正确的是( )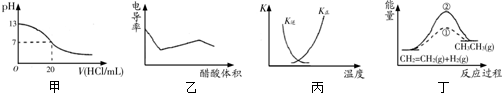
| A. | 甲表示25℃时用0.1 mol/L的盐酸滴定20 mL 0.1 mol/L KOH溶液,溶液的pH随加入盐酸体积的变化 | |
| B. | 乙表示醋酸溶液滴定NaOH和氨水混合溶液的电导率曲线 | |
| C. | 丙中曲线表示反应N2(g)+3H2(g)?2NH3(g)△H<0正、逆反应的平衡常数K随温度的变化 | |
| D. | 丁中①、②曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未用催化剂时,反应过程中的能量变化 |
分析 A.当溶液pH=7时,氢氧化钠就与氯化氢恰好反应,滴定曲线应该有一个滴定突变;
B.醋酸和一水合氨是弱电解质,在溶液里部分电离,氢氧化钠是强电解质,完全电离,向混合溶液中滴加醋酸,醋酸先和氢氧化钠反应生成强电解质醋酸钠,氢氧化钠完全反应后,醋酸再和氨水反应生成强电解质醋酸铵,再根据溶液中离子浓度变化与电导率的关系判断;
C.升高温度,平衡逆向越大,正反应平衡常数减小、逆反应的平衡常数增大,相同温度下二者乘积为1;
D.使用催化剂降低活化能,不影响反应热,该反应是放热反应,应反应物的总能量大于生成物的总能量.
解答 解:A.用盐酸滴定氢氧化钠溶液,当恰好中和时溶液的pH=7,酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大,题中图象变化与实际不相符,故A错误;
B.氢氧化钠是强电解质,氨水是弱电解质,滴加的弱电解质先和氢氧化钠反应生成强电解质醋酸钠,但溶液体积不断增大,溶液被稀释,所以电导率下降;当氢氧化钠完全被中和后,醋酸继续与弱电解质氨水反应生成强电解质醋酸铵,所以电导率增大;氨水也完全反应后,继续滴加醋酸,因为溶液被稀释,电导率有下降趋势,故B正确;
C.因反应为放热反应,则升高温度,平衡逆向移动,平衡后升温K(逆)会增大,而K(正)会减小,且正逆反应的平衡常数互为倒数关系,图象中变化与实际上的变化不相符,故C错误;
D.图象a活化能减小,a使用了催化剂,因该反应是放热反应,应反应物的总能量大于生成物的总能量,但图象描述是吸热反应,故D错误.
故选:B.
点评 本题考查酸碱中和滴定、平衡常数影响因素、电解质溶液导电性、化学反应中能量变化等,侧重考查学生读图获取信息的能力、知识迁移运用能力,主要考查一些细节问题,属于易错题目.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列实验操作与实验目的相符的是( )
| 序号 | 实验操作 | 实验目的 |
| A | 测定HF、HCl熔点、沸点 | 比较F和Cl的非金属性强弱 |
| B | MgSO4、Al2(SO4)3溶液中分别滴加足量氨水 | 比较镁、铝的金属性强弱 |
| C | 测定等浓度的H2CO3、H2SO3两溶液的pH | 比较碳、硫的非金属性强弱 |
| D | 向氯化铵、氯化铝混合溶液中滴加氢氧化钠溶液至过量 | 比较氨水和氢氧化铝的碱性强弱 |
| A. | A | B. | B | C. | C | D. | D |
2.常温下,含a mol CH3COOH和b mol NaOH的两溶液混合后,下列推论不正确的是( )
| A. | 若a≤b,则混合溶液的pH大于7 | |
| B. | 若a=2b,溶液呈酸性,则[CH3COO-]>[Na+]>[CH3COOH]>[H+]>[OH-] | |
| C. | 混合溶液中[Na+]+[H+]=[OH-]+[CH3COO-]一定成立 | |
| D. | 混合溶液中[CH3COO-]+[CH3COOH]=a mol/L 一定成立 |
19. 用0.1032mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,
用0.1032mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,
(1)某同学按下列步骤进行实验:①取一锥形瓶,用待测NaOH溶液润洗两次; ②在锥形瓶中加入
25,.00 mL待测NaOH溶液;③加入几滴石蕊试剂做指示剂;④取一支酸式滴定管,洗涤干净; ⑤直接往酸式滴定管中注入标准酸溶液,进行滴定; ⑥两眼注视着滴定管内盐酸溶液液面下降,直至滴定终点.
其中所述操作有错误的序号为①③⑤⑥
(2)取用25.00 mL待测NaOH溶液应用以下乙(选填:“甲”、“乙”)装置,若取用NaOH溶液开始平视读数、结束时俯视读数,会导致所测氢氧化钠溶液浓度偏大(填“偏大““偏小“或“不变“)
(3)若滴定开始前滴定管尖嘴中有一气泡,滴定结束后气泡消失,
则会导致所测氢氧化钠溶液浓度偏大(填“偏大““偏小“或“不变“)
(4)若平行实验三次,记录的数据如下表
试计算待测NaOH溶液的物质的量浓度(列出计算过程).
 用0.1032mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,
用0.1032mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,(1)某同学按下列步骤进行实验:①取一锥形瓶,用待测NaOH溶液润洗两次; ②在锥形瓶中加入
25,.00 mL待测NaOH溶液;③加入几滴石蕊试剂做指示剂;④取一支酸式滴定管,洗涤干净; ⑤直接往酸式滴定管中注入标准酸溶液,进行滴定; ⑥两眼注视着滴定管内盐酸溶液液面下降,直至滴定终点.
其中所述操作有错误的序号为①③⑤⑥
(2)取用25.00 mL待测NaOH溶液应用以下乙(选填:“甲”、“乙”)装置,若取用NaOH溶液开始平视读数、结束时俯视读数,会导致所测氢氧化钠溶液浓度偏大(填“偏大““偏小“或“不变“)
(3)若滴定开始前滴定管尖嘴中有一气泡,滴定结束后气泡消失,
则会导致所测氢氧化钠溶液浓度偏大(填“偏大““偏小“或“不变“)
(4)若平行实验三次,记录的数据如下表
| 滴定次数 | 待测溶液的体积(/mL) | 标准HCl溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 2.00 | 22.98 |
| 3 | 25.00 | 0.20 | 20.18 |
6.下列有机物的性质差异是由于相同的官能团受不同邻近基团影响而产生的是( )
| A. | 己烷不能使Br2的四氯化碳溶液褪色而己烯能使其褪色 | |
| B. | 葡萄糖与新制的Cu(OH)2悬浊液共热生成砖红色而果糖不能 | |
| C. | 苯酚( )与溴的水溶液反应生成白色沉淀而甲苯不能 )与溴的水溶液反应生成白色沉淀而甲苯不能 | |
| D. | 乙烷与Cl2单质发生取代反应而乙烯与Cl2单质易发生加成反应 |
16.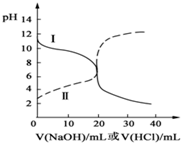 25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中,pH随着滴加溶液的体积变化如图所示.下列说法不正确的是( )
25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中,pH随着滴加溶液的体积变化如图所示.下列说法不正确的是( )
 25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中,pH随着滴加溶液的体积变化如图所示.下列说法不正确的是( )
25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中,pH随着滴加溶液的体积变化如图所示.下列说法不正确的是( )| A. | 曲线Ⅱ:滴加溶液到10mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | 曲线Ⅱ:滴加溶液到10mL时:c(CH3COO-)-c(CH3COOH)═2[c(OH-)-c(H+)] | |
| C. | 曲线Ⅰ:滴加溶液在10mL-20mL之间存在:c(Cl-)═c(NH4+)>c(OH-)═c(H+) | |
| D. | 曲线Ⅰ:滴加溶液到20mL时:c(Cl-)>c(NH4+)>c(H+)>c(NH3•H2O)>c(OH-) |
3.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
请回答:
(1)从①组实验分析,HA是弱酸(填“强酸”或“弱酸”).
(2)②组实验表明,c大于0.2(填“大于”、“小于”或“等于”).混合液中离子浓度c(A-)与c(Na+)的大小关系是c(A-)=c(Na+).
(3)从③组实验结果分析,说明HA的电离程度大于(填“大于”、“小于”或“等于”)NaA的水解程度,该混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
(4)①组实验所得的混合溶液中,下列算式的精确结果是:c(OH-)-c(HA)=10-9mol/L.
| 实验 编号 | HA物质的量 浓度(mol•L-1) | NaOH物质的量 浓度(mol•L-1) | 混合溶 液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
(1)从①组实验分析,HA是弱酸(填“强酸”或“弱酸”).
(2)②组实验表明,c大于0.2(填“大于”、“小于”或“等于”).混合液中离子浓度c(A-)与c(Na+)的大小关系是c(A-)=c(Na+).
(3)从③组实验结果分析,说明HA的电离程度大于(填“大于”、“小于”或“等于”)NaA的水解程度,该混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
(4)①组实验所得的混合溶液中,下列算式的精确结果是:c(OH-)-c(HA)=10-9mol/L.
20.在298K时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:
下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 反应可表示为X(g)+3Y(g)?2Z(g),其平衡常数为1600 (L/mol)2 | |
| C. | 增大压强,平衡常数增大 | |
| D. | 改变温度可以改变此反应的平衡常数 |
1.元素X形成的离子与镁离子的核外电子排布相同,且X的离子半径小于负二价氧离子的半径.X元素可能为( )
| A. | Ne | B. | N | C. | Na | D. | K |