题目内容
16.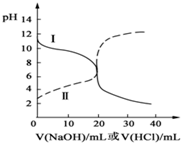 25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中,pH随着滴加溶液的体积变化如图所示.下列说法不正确的是( )
25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中,pH随着滴加溶液的体积变化如图所示.下列说法不正确的是( )| A. | 曲线Ⅱ:滴加溶液到10mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | 曲线Ⅱ:滴加溶液到10mL时:c(CH3COO-)-c(CH3COOH)═2[c(OH-)-c(H+)] | |
| C. | 曲线Ⅰ:滴加溶液在10mL-20mL之间存在:c(Cl-)═c(NH4+)>c(OH-)═c(H+) | |
| D. | 曲线Ⅰ:滴加溶液到20mL时:c(Cl-)>c(NH4+)>c(H+)>c(NH3•H2O)>c(OH-) |
分析 根据曲线变化趋势知,当未滴加溶液时,曲线I的pH>7,说明属于酸滴定碱溶液,根据曲线变化趋势知,当未滴加溶液时,曲线II的pH<7,说明属于碱滴定酸溶液;
A.曲线II为氢氧化钠滴定醋酸溶液的曲线,滴加溶液到10 mL时,溶液中的溶质是等物质的量浓度的醋酸和醋酸钠,溶液显酸性;
B.曲线II为氢氧化钠滴定醋酸溶液的曲线,滴加溶液到10 mL时,溶液中的溶质是等物质的量浓度的醋酸和醋酸钠,结合物料守恒及电荷守恒分析;
C.曲线I为酸滴定碱溶液,当滴加溶液在10mL-20mL之间,溶液中的溶质是氯化铵和一水合氨;
D.曲线I为酸滴定碱溶液,当滴加溶液到20mL时,溶液中的溶质是氯化铵,铵根离子水解,且水解程度很弱.
解答 解:根据曲线变化趋势知,当未滴加溶液时,曲线I的pH>7,说明属于酸滴定碱溶液,根据曲线变化趋势知,当未滴加溶液时,曲线II的pH<7,说明属于碱滴定酸溶液;
A.曲线II为氢氧化钠滴定醋酸溶液的曲线,滴加溶液到10 mL时,溶液中的溶质是等物质的量浓度的醋酸和醋酸钠,溶液显酸性,所以c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故A正确;
B.曲线II为氢氧化钠滴定醋酸溶液的曲线,滴加溶液到10 mL时,溶液中的溶质是等物质的量浓度的醋酸和醋酸钠,溶液中存在物料守恒c(CH3COO-)+c(CH3COOH)=2c(Na+),溶液中存在电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+),所以得c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)],故B错误;
C.曲线I为酸滴定碱溶液,当滴加溶液在10mL-20mL之间,溶液中的溶质是氯化铵和一水合氨,溶液呈碱性,则c(H+)<c(OH-),故C错误;
D.曲线I为酸滴定碱溶液,当滴加溶液到20mL时,溶液中的溶质是氯化铵,溶液呈酸性,则c(H+)>c(OH-),溶液中存在电荷守恒c(Cl-)+c(OH-)=c(NH4+)+c(H+),所以得c(Cl-)>c(NH4+),盐类水解程度较小,水电离出氢离子,所以离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(NH3•H2O)>c(OH-),故D正确;
故选BC.
点评 本题考查了酸碱混合溶液定性判断,把握滴定曲线的判断及溶液中的溶质、电荷守恒和物料守恒为解答的关键,侧重分析与应用能力的综合考查,题目难度中等.

 精英口算卡系列答案
精英口算卡系列答案| A. |  验证化学能转化为电能 | B. |  制备无水氯化镁 | ||
| C. |  制备Fe(OH)2 | D. |  配制一定物质的量浓度的溶液 |
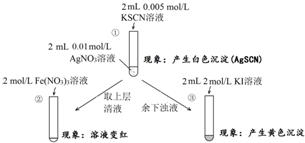
| A. | ①浊液中存在平衡:AgSCN(s)?Ag+(aq)+SCN-(aq) | |
| B. | ②中颜色变化说明上层清液中含有SCN- | |
| C. | ③中颜色变化说明有AgI生成 | |
| D. | 该实验可以证明AgI比AgSCN更难溶 |
| 坩埚的质量 | 坩埚的质量+晶体质量 | 失水后坩埚的质量+固体质量 |
| 11.70g | 14.2g | 13.2g |
| A. | 晶体中含有不分解的杂质 | B. | 没有放在干燥器中冷却 | ||
| C. | 实验前,晶体表面吸附水 | D. | 没有进行恒重操作 |
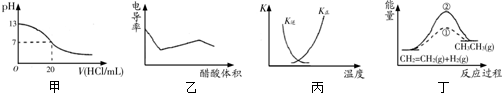
| A. | 甲表示25℃时用0.1 mol/L的盐酸滴定20 mL 0.1 mol/L KOH溶液,溶液的pH随加入盐酸体积的变化 | |
| B. | 乙表示醋酸溶液滴定NaOH和氨水混合溶液的电导率曲线 | |
| C. | 丙中曲线表示反应N2(g)+3H2(g)?2NH3(g)△H<0正、逆反应的平衡常数K随温度的变化 | |
| D. | 丁中①、②曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未用催化剂时,反应过程中的能量变化 |
①HF(aq)+OH-(aq)?H2O(l)+F(aq)△H=-67.7kJ/mol
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol
在20Ml0.lmol/L的氢氟酸中滴加0.lmol/L的NaOH V mL,下列说法正确的是( )
| A. | 氢氟酸的电离方程式及热效应可表示为:HF(aq)?H+(aq)+F-(aq)△H=+10.4kJ/mol | |
| B. | 当V=20 mL时,溶液中:c(OH-)=c(HF)+c(H+) | |
| C. | 当V=20 mL时,溶液中:c(F-)=c(Na+)=0.1mol/L | |
| D. | 当v>0时,溶液中一定存在c(Na+)>c(F-)>c(OH-)>c(H+) |
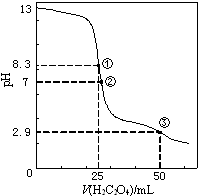 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )
25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-) | |
| B. | 点②所示溶液中:c(HC2O4-)+2c(C2O42-)=c(Na+) | |
| C. | 点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| D. | 滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-) |
 请按要求回答下列问题.
请按要求回答下列问题.