题目内容
13.下列实验操作与实验目的相符的是( )| 序号 | 实验操作 | 实验目的 |
| A | 测定HF、HCl熔点、沸点 | 比较F和Cl的非金属性强弱 |
| B | MgSO4、Al2(SO4)3溶液中分别滴加足量氨水 | 比较镁、铝的金属性强弱 |
| C | 测定等浓度的H2CO3、H2SO3两溶液的pH | 比较碳、硫的非金属性强弱 |
| D | 向氯化铵、氯化铝混合溶液中滴加氢氧化钠溶液至过量 | 比较氨水和氢氧化铝的碱性强弱 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.熔沸点属于物理性质,非金属性强弱属于化学性质;
B.复分解反应不能用以比较非金属性强弱;
C.比较非金属性应是最高价氧化物对应的水化物;
D.向氯化铵、氯化铝混合溶液中滴加氢氧化钠溶液至过量,首先形成氢氧化铝白色沉淀,后沉淀的物质的量不变,后来沉淀溶解,变为澄清溶液.
解答 解:A.HF、HCl的熔点、沸点属于物理性质,非金属性强弱属于化学性质,不能用物理性质来比较化学性质,故A错误;
B.MgSO4、Al2(SO4)3溶液中分别滴加足量氨水都生成沉淀,属于复分解反应,不能用来比较非金属性强弱,故B错误;
C.H2SO3不是S元素最高价的含氧酸,所以不能通过测定等浓度的H2CO3、H2SO3两溶液的pH比较碳、硫的非金属性强弱,故C错误;
D.向氯化铵、氯化铝混合溶液中滴加氢氧化钠溶液至过量,首先形成氢氧化铝白色沉淀,后沉淀的物质的量不变,后来沉淀溶解,变为澄清溶液,可以比较氨水和氢氧化铝的碱性强弱,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及非金属性、金属性的实验设计,题目易错点为C,注意比较非金属性应是最高价氧化物对应的水化物,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.某烃的结构简式为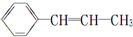 ,下列关于该烃的说法错误的是( )
,下列关于该烃的说法错误的是( )
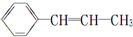 ,下列关于该烃的说法错误的是( )
,下列关于该烃的说法错误的是( )| A. | 该烃易溶于有机溶剂,但不易溶于水 | |
| B. | 1 mol该烃含有1 mol碳碳双键 | |
| C. | 既能使溴水褪色,又能使酸性KMnO4溶液褪色 | |
| D. | 能发生聚合反应,其产物可表示为: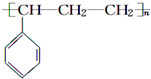 |
4.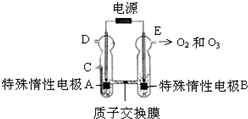 臭氧是一种强氧化剂,常用于消毒、灭菌等.
臭氧是一种强氧化剂,常用于消毒、灭菌等.
(1)已知O3与KI溶液反应的生成物中有两种单质是I2和O2.
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示.
已知:O3的起始浓度为0.0216mol/L.
①pH增大能加速O3分解,表明对O3分解起催化作用的是OH-.
②在30°C、pH=4.0条件下,O3的分解速率为1.00×10-4 mol/(L•min).
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为bac.(填字母代号)
a.40°C、pH=3.0 b.10°C、pH=4.0 c.30°C、pH=7.0
(3)O3可由臭氧发生器(原理如下图)电解稀硫酸制得.
①图中阴极为A(填“A”或“B”),其电极反应式为2H++2e-=H2↑.
②若C处通入O2,则A极的电极反应式为O2+4H++4e-=2H2O.
 臭氧是一种强氧化剂,常用于消毒、灭菌等.
臭氧是一种强氧化剂,常用于消毒、灭菌等.(1)已知O3与KI溶液反应的生成物中有两种单质是I2和O2.
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示.
已知:O3的起始浓度为0.0216mol/L.
pH t/min T/℃ | 3,.0 | 4,.0 | 5,.0 | 6,.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
②在30°C、pH=4.0条件下,O3的分解速率为1.00×10-4 mol/(L•min).
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为bac.(填字母代号)
a.40°C、pH=3.0 b.10°C、pH=4.0 c.30°C、pH=7.0
(3)O3可由臭氧发生器(原理如下图)电解稀硫酸制得.
①图中阴极为A(填“A”或“B”),其电极反应式为2H++2e-=H2↑.
②若C处通入O2,则A极的电极反应式为O2+4H++4e-=2H2O.
1.下列离子方程式不正确的是( )
| A. | 在一定量的Ba(OH)2溶液中通入过量SO2气体SO2+OH-═HS${{O}_{3}}^{-}$ | |
| B. | 4 mol•L-1的NaAlO2溶液和7 mol•L-1的盐酸等体积混合4 Al${O}_{2}^{-}$+7H++H2O═3Al(OH)3↓+Al3+ | |
| C. | 在碳酸氢钠溶液中加入等物质的量的氢氧化钙溶液Ca2++HC${O}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| D. | 用惰性电极电解氯化铝溶液2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- |
18.下列操作正确且能达到实验目的是( )
| A. |  验证化学能转化为电能 | B. |  制备无水氯化镁 | ||
| C. |  制备Fe(OH)2 | D. |  配制一定物质的量浓度的溶液 |
5.关于氢元素的下列叙述,正确的是( )
| A. | 氢有三种同素异形体,分别是氕、氘、氚 | |
| B. | 氢有三种同位素,它们的相对原子质量分别是1、2、3 | |
| C. | 氢元素可形成三种互为通分异构体的物质:H2、D2、T2 | |
| D. | 氢元素的三种同位素原子可用一个原子结构示意图表示 |
11.关于下图的说法正确的是( )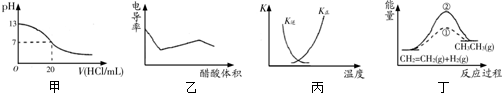

| A. | 甲表示25℃时用0.1 mol/L的盐酸滴定20 mL 0.1 mol/L KOH溶液,溶液的pH随加入盐酸体积的变化 | |
| B. | 乙表示醋酸溶液滴定NaOH和氨水混合溶液的电导率曲线 | |
| C. | 丙中曲线表示反应N2(g)+3H2(g)?2NH3(g)△H<0正、逆反应的平衡常数K随温度的变化 | |
| D. | 丁中①、②曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未用催化剂时,反应过程中的能量变化 |
 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):