题目内容
 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
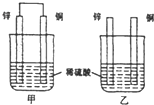
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.(1)将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
①下列说法正确的是
A.甲乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少,乙中锌片质量减少
D.两烧杯中溶液的PH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲
③该反应是
④当乙中产生1.12L(标准状况)气体时,将锌﹑铜片取出,再将烧杯中的溶液稀释至1L,测得溶液中c(H+)=0.1mol?L-1(设反应前后溶液体积不变)试确定原稀硫酸的物质的量浓度为
(2)电子表和电子计算器中所用的是纽扣式微型银锌电池,其电极分别为Ag2O和Zn,电解质为KOH溶液,放电时电池总反应为Ag2O+Zn+H2O═2Ag+Zn(OH)2,工作时电池正极区的PH
NA个电子,理论上消耗的锌的质量
(3)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸,工作时该电池总反应式为:PbO2+Pb+2H2SO4═2PbSO4+2H2O,据此判断:铅蓄电池的负极材料是
考点:常见化学电源的种类及其工作原理,原电池和电解池的工作原理
专题:电化学专题
分析:(1)①甲构成原电池,甲中锌作负极、Cu作正极,乙不能构成原电池,锌发生化学腐蚀;
②原电池加快负极金属被腐蚀速率;
③原电池反应是放热反应;
④根据H原子守恒计算硫酸物质的量浓度;根据氢气和转移电子之间的关系式计算转移电子数;
(2)负极反应式为负极电极反应式为Zn+2OH--2e-=Zn(OH)2,正极的电极反应式为Ag2O+H2O+2e-=2Ag+2OH-,据此判断正极附近溶液pH变化,根据锌和转移电子之间的关系式计算消耗锌的质量;
(3)负极上失电子发生氧化反应,正极上得电子发生还原反应;放电时,硫酸参加反应导致氢离子浓度降低;放电时,电解质溶液中阳离子向正极移动,阴离子向负极移动.
②原电池加快负极金属被腐蚀速率;
③原电池反应是放热反应;
④根据H原子守恒计算硫酸物质的量浓度;根据氢气和转移电子之间的关系式计算转移电子数;
(2)负极反应式为负极电极反应式为Zn+2OH--2e-=Zn(OH)2,正极的电极反应式为Ag2O+H2O+2e-=2Ag+2OH-,据此判断正极附近溶液pH变化,根据锌和转移电子之间的关系式计算消耗锌的质量;
(3)负极上失电子发生氧化反应,正极上得电子发生还原反应;放电时,硫酸参加反应导致氢离子浓度降低;放电时,电解质溶液中阳离子向正极移动,阴离子向负极移动.
解答:
解:(1)①甲构成原电池,甲中锌作负极、Cu作正极,乙不能构成原电池,锌发生化学腐蚀,
A.甲为化学能转变为电能的装置,乙不是,故错误;
B.乙不能构成原电池,铜和稀硫酸不反应,所以乙中铜片上没有明显变化,故正确;
C.甲中铜片上生成氢气,所以铜片质量不变,故错误;
D.两烧杯溶液中氢离子都得电子生成氢气,导致氢离子浓度降低,则溶液的PH均增大,故正确;
故选BD;
②原电池加快负极金属被腐蚀速率,所以在相同时间内,两烧杯中产生气泡的速度:甲>乙,故答案为:>;
③酸和金属的反应、原电池反应都是放热反应,故答案为:放热;
④乙中生成n(H2)=
=0.05mol,根据n(H+)=2n(H2)知,生成氢气消耗n(H+)为0.1mol,反应后溶液中c(H+)=0.1mol?L-1,则反应前c(H+)=
+0.1mol?L-1=0.2mol/L,根据H原子守恒知,
c(H+)=c(H2SO4)=0.1mol/L,根据2H++2e-=H2↑知,转移电子数=0.05mol×2×NA/mol=0.1NA,
故答案为:0.1mol/L;0.1NA;
(2)负极反应式为负极电极反应式为Zn+2OH--2e-=Zn(OH)2,正极的电极反应式为Ag2O+H2O+2e-=2Ag+2OH-,正极上生成氢氧根离子,则溶液pH增大;根据Zn+2OH--2e-=Zn(OH)2得消耗锌的质量=
×65g/mol=58.5g,故答案为:增大;58.5;
(3)该反应中Pb中Pb元素化合价由0价变为+2价,PbO2中Pb元素由+4价变为+2价,所以Pb为负极,PbO2为正极,根据电池反应式知,放电时,硫酸参加反应导致硫酸浓度减小,则溶液的酸性减小,电解质溶液中阴离子硫酸根离子向负极移动、阳离子氢离子向正极移动,故答案为:Pb;减小;负.
A.甲为化学能转变为电能的装置,乙不是,故错误;
B.乙不能构成原电池,铜和稀硫酸不反应,所以乙中铜片上没有明显变化,故正确;
C.甲中铜片上生成氢气,所以铜片质量不变,故错误;
D.两烧杯溶液中氢离子都得电子生成氢气,导致氢离子浓度降低,则溶液的PH均增大,故正确;
故选BD;
②原电池加快负极金属被腐蚀速率,所以在相同时间内,两烧杯中产生气泡的速度:甲>乙,故答案为:>;
③酸和金属的反应、原电池反应都是放热反应,故答案为:放热;
④乙中生成n(H2)=
| 1.12L |
| 22.4L/mol |
| 0.1mol |
| 1L |
| 1 |
| 2 |
故答案为:0.1mol/L;0.1NA;
(2)负极反应式为负极电极反应式为Zn+2OH--2e-=Zn(OH)2,正极的电极反应式为Ag2O+H2O+2e-=2Ag+2OH-,正极上生成氢氧根离子,则溶液pH增大;根据Zn+2OH--2e-=Zn(OH)2得消耗锌的质量=
| ||
| 2 |
(3)该反应中Pb中Pb元素化合价由0价变为+2价,PbO2中Pb元素由+4价变为+2价,所以Pb为负极,PbO2为正极,根据电池反应式知,放电时,硫酸参加反应导致硫酸浓度减小,则溶液的酸性减小,电解质溶液中阴离子硫酸根离子向负极移动、阳离子氢离子向正极移动,故答案为:Pb;减小;负.
点评:本题考查了原电池原理,明确原电池各个电极上发生的反应是解本题关键,会正确书写电极反应式,注意(1)中电池反应式和乙中化学反应方程式相同,题目难度不大.

练习册系列答案
相关题目
下列操作中错误的是.( )
| A、除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯 |
| B、分离乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃):蒸馏 |
| C、取待测液与氢氧化钠共热,产生刺激性气体能使湿润的红色石蕊试纸变蓝,含NH4+ |
| D、分离溶解在水中的少量溴:加入CCl4,使用分液漏斗进行萃取 |
关于1mol H2O的叙述正确的是( )
| A、含有1mol氢气 |
| B、质量为18g/mol |
| C、在标准状况下的体积为22.4L |
| D、含有水分子的个数约为6.02×1023 |
短周期主族元素W、R、X、Y、Z的原子序数依次增大,且分别占有三个不同的周期.W与X同主族,R与Z同主族,R最外层电子数是其内层电子数的3倍,Y是地壳中含量最多的金属元素.下列说法正确的是( )
| A、W、X是金属元素 |
| B、原子半径:R<Y<Z |
| C、简单气态氢化物的热稳定性:Z>R |
| D、X、Y、Z的最高价氧化物对应的水化物能相互反应 |
下列选项中正确的是( )
| A、1L 0.5mol?L-1稀硫酸与1L 1mol?L-1氢氧化钠溶液反应放出57.3kJ的热量:H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l);△H=-57.3kJ?mol-1 | ||||
| B、某酸的酸式盐NaHY水溶液显碱性,则H2Y?2H++Y2- | ||||
| C、纯碱溶液显碱性的原因用离子方程式可表示为:CO32-+2H2O?H2CO3+2OH- | ||||
D、以惰性电极电解KCl溶液的离子方程式为:2Cl-+2H2O
|
 如图每一方框中的字母代表一种反应物或生成物.产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,H在常温下是臭鸡蛋气味的气体,C在空气中燃烧生成淡黄色固体,D是淡黄色固体单质.试填写下列空白:
如图每一方框中的字母代表一种反应物或生成物.产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,H在常温下是臭鸡蛋气味的气体,C在空气中燃烧生成淡黄色固体,D是淡黄色固体单质.试填写下列空白: 铁、钴、镍为第四周期第Ⅷ族元素,它们的性质非常相似,也称为铁系元素.
铁、钴、镍为第四周期第Ⅷ族元素,它们的性质非常相似,也称为铁系元素. 是由一种单体缩聚而成的,该单体的结构简式为
是由一种单体缩聚而成的,该单体的结构简式为 的一氯取代物有
的一氯取代物有