题目内容
氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应.请回答下列问题:
(1)该反应的离子方程式为 ;
(2)估算该离子反应的平衡常数
(3)在上述平衡体系中加入少量NaOH固体,平衡将向 反应方向移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将 (填“增大”、“减小”或“不变”),平衡将向 反应方向移动.
(5)下列事实不能用勒夏特列原理解释的是
A.实验室将氨水放在低温处密封保存
B.对于2HI(g)?H2(g)+I2(g);△H>0,缩小容器的体积可使颜色变深.
C.在实验室可用排饱和食盐水的方法收集氯气.
D.冰镇啤酒瓶,把啤酒倒入玻璃杯,杯中立即泛起大量泡沫.
(1)该反应的离子方程式为
(2)估算该离子反应的平衡常数
(3)在上述平衡体系中加入少量NaOH固体,平衡将向
(4)如果增大氯气的压强,氯气在水中的溶解度将
(5)下列事实不能用勒夏特列原理解释的是
A.实验室将氨水放在低温处密封保存
B.对于2HI(g)?H2(g)+I2(g);△H>0,缩小容器的体积可使颜色变深.
C.在实验室可用排饱和食盐水的方法收集氯气.
D.冰镇啤酒瓶,把啤酒倒入玻璃杯,杯中立即泛起大量泡沫.
考点:氯气的化学性质,化学平衡的影响因素,化学平衡移动原理
专题:基本概念与基本理论,卤族元素
分析:(1)氯气与水反应生成盐酸和次氯酸,次氯酸是弱电解质;
(2)在1L水中可溶解0.09mol氯气,近似氯气浓度为0.09mol/L,结合平衡的浓度计算平衡常数;
(3)加入氢氧化钠,溶液中的氢氧根离子,和氢离子反应,平衡正向进行;
(4)气体溶解度随压强增大会增大,平衡向气体体积减小的方向进行;
(5)能发生平衡移动的可逆反应能用勒夏特列原理解释.
(2)在1L水中可溶解0.09mol氯气,近似氯气浓度为0.09mol/L,结合平衡的浓度计算平衡常数;
(3)加入氢氧化钠,溶液中的氢氧根离子,和氢离子反应,平衡正向进行;
(4)气体溶解度随压强增大会增大,平衡向气体体积减小的方向进行;
(5)能发生平衡移动的可逆反应能用勒夏特列原理解释.
解答:
解:(1)氯气与水反应生成盐酸和次氯酸,反应的离子方程式为:Cl2+H2O?H++Cl-+HClO,故答案为:Cl2+H2O?H++Cl-+HClO;
(2)在1L水中可溶解0.09mol氯气,近似氯气浓度为0.09mol/L,则
Cl2+H2O?H++Cl-+HClO
起始浓度:0.09 0 0 0
转化浓度:0.03 0.03 0.03 0.03
平衡浓度:0.06 0.03 0.03 0.03
K=
=4.5×10-4,故答案为:4.5×10-4;
(3)在上述平衡体系中加入少量NaOH固体,会和平衡状态下的氢离子反应,平衡正向进行,故答案为:正;
(4)在上述平衡中加压,平衡向气体体积减小的反应方向进行,平衡都向正反应方向移动,氯气的溶解量会增加,故答案为:增大;正;
(5)A.实验室将氨水放在低温处密封保存,是因温度升高使NH3+H2O?NH3.H2O逆向移动,可用勒夏特列原理解释,故A不选;
B.对于2HI(g)?H2(g)+I2(g)△H>0,缩小容器的体积可使颜色变深,浓度增大,但平衡不移动,则不能用勒夏特列原理解释,故B选;
C.在实验室可用排饱和食盐水的方法收集氯气,使因食盐水中氯离子抑制氯气溶解,使Cl2+H2O?HCl+HClO逆向移动,可用勒夏特列原理解释,故C不选;
D.冰镇啤酒瓶,把啤酒倒入玻璃杯,杯中立即泛起大量泡沫,是因压强减小,二氧化碳逸出,CO2+H2O?H2CO3逆向移动,可用勒夏特列原理解释,故D不选;
故答案为:B.
(2)在1L水中可溶解0.09mol氯气,近似氯气浓度为0.09mol/L,则
Cl2+H2O?H++Cl-+HClO
起始浓度:0.09 0 0 0
转化浓度:0.03 0.03 0.03 0.03
平衡浓度:0.06 0.03 0.03 0.03
K=
| 0.03×0.03×0.03 |
| 0.06 |
(3)在上述平衡体系中加入少量NaOH固体,会和平衡状态下的氢离子反应,平衡正向进行,故答案为:正;
(4)在上述平衡中加压,平衡向气体体积减小的反应方向进行,平衡都向正反应方向移动,氯气的溶解量会增加,故答案为:增大;正;
(5)A.实验室将氨水放在低温处密封保存,是因温度升高使NH3+H2O?NH3.H2O逆向移动,可用勒夏特列原理解释,故A不选;
B.对于2HI(g)?H2(g)+I2(g)△H>0,缩小容器的体积可使颜色变深,浓度增大,但平衡不移动,则不能用勒夏特列原理解释,故B选;
C.在实验室可用排饱和食盐水的方法收集氯气,使因食盐水中氯离子抑制氯气溶解,使Cl2+H2O?HCl+HClO逆向移动,可用勒夏特列原理解释,故C不选;
D.冰镇啤酒瓶,把啤酒倒入玻璃杯,杯中立即泛起大量泡沫,是因压强减小,二氧化碳逸出,CO2+H2O?H2CO3逆向移动,可用勒夏特列原理解释,故D不选;
故答案为:B.
点评:本题考查氯气的性质,为高频考点,把握氯气的性质、化学平衡移动影响因素及原理为解答的关键,侧重化学平衡移动原理及应用的考查,注重分析与应用能力的训练,题目难度不大.

练习册系列答案
相关题目
甲酸的下列性质中,可以证明它是弱电解质的是( )
| A、甲酸能与水以任意比互溶 |
| B、1mol/L甲酸溶液的PH约为2 |
| C、10mL1mol/L甲酸恰好与10mL1mol/LNaOH溶液完全反应 |
| D、在相同条件下,甲酸溶液的导电性比强酸溶液的弱 |
 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
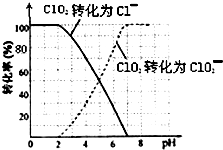 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.比Cl2更好.
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.比Cl2更好.