题目内容
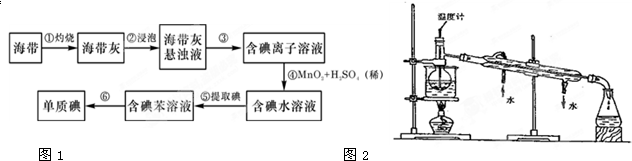
 如图每一方框中的字母代表一种反应物或生成物.产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,H在常温下是臭鸡蛋气味的气体,C在空气中燃烧生成淡黄色固体,D是淡黄色固体单质.试填写下列空白:
如图每一方框中的字母代表一种反应物或生成物.产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,H在常温下是臭鸡蛋气味的气体,C在空气中燃烧生成淡黄色固体,D是淡黄色固体单质.试填写下列空白:(1)L的化学式为
(2)F的化学式为
(3)J的化学式为
(4)E是
(5)J受热分解反应的化学方程式为
(6)H和G之间反应的化学方程式为
(7)A与足量的NaOH反应的化学方程式为
考点:无机物的推断
专题:推断题
分析:从“D是淡黄色固体单质”可初步认定是硫,G是二氧化硫;从“J是含A金属元素的胶状白色沉淀”可初步认定A是铝,J是氢氧化铝;从“I为NaCl溶液”可推出C为钠,F为硫化钠,B为Cl2,E为AlCl3,L为H2O,H为H2S,H2S与SO2间发生氧化还原反应生成S和H2O,证明上述推断的正确性;根据物质的性质和质量守恒定律书写化学方程式.
解答:
解:从“D是淡黄色固体单质”可初步认定是硫,G是二氧化硫;从“J是含A金属元素的胶状白色沉淀”可初步认定A是铝,J是氢氧化铝;从“I为NaCl溶液”可推出C为钠,F为硫化钠,B为Cl2,E为AlCl3,L为H2O,H为H2S,H2S与SO2间发生氧化还原反应生成S和H2O,证明上述推断的正确性;
(1)中学阶段学习过的淡黄色固体单质为S,则G是二氧化硫,与SO2反应生成S的物质为H2S,二者反应生成S和水,故答案为:H2O;
(2)从“J是含A金属元素的胶状白色沉淀”可初步认定A是铝,J是氢氧化铝;从“I为NaCl溶液”可推出C为钠,F为硫化钠,B为Cl2,E为AlCl3,L为H2O,H为H2S,故答案为:Na2S;
(3)J的化学式为Al(OH)3 ;
故答案为:Al(OH)3;
(4)E为AlCl3属于共价化合物;
故答案为:共价;
(5)氢氧化铝在高温下分解生成Al2O3和H2O.根据质量守恒定律可写出化学方程式:2Al(OH)3
Al2O3+3H2O,
故答案为:2Al(OH)3
Al2O3+3H2O;
(6)SO2具有氧化性,H2S具还原性,二者发生氧化还原反应生成S和H2O,故答案为:2H2S+SO2═3S+2H2O;
(7)A与足量的NaOH反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2 NaOH+2H2O═2 NaAlO2+3H2↑;
故答案为:2Al+2 NaOH+2H2O═2 NaAlO2+3H2↑;
(1)中学阶段学习过的淡黄色固体单质为S,则G是二氧化硫,与SO2反应生成S的物质为H2S,二者反应生成S和水,故答案为:H2O;
(2)从“J是含A金属元素的胶状白色沉淀”可初步认定A是铝,J是氢氧化铝;从“I为NaCl溶液”可推出C为钠,F为硫化钠,B为Cl2,E为AlCl3,L为H2O,H为H2S,故答案为:Na2S;
(3)J的化学式为Al(OH)3 ;
故答案为:Al(OH)3;
(4)E为AlCl3属于共价化合物;
故答案为:共价;
(5)氢氧化铝在高温下分解生成Al2O3和H2O.根据质量守恒定律可写出化学方程式:2Al(OH)3
| ||
故答案为:2Al(OH)3
| ||
(6)SO2具有氧化性,H2S具还原性,二者发生氧化还原反应生成S和H2O,故答案为:2H2S+SO2═3S+2H2O;
(7)A与足量的NaOH反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2 NaOH+2H2O═2 NaAlO2+3H2↑;
故答案为:2Al+2 NaOH+2H2O═2 NaAlO2+3H2↑;
点评:本题考查了物质转化关系分析判断,此类题目考查学生对元素化合物知识的熟悉程度,同时很好的考查学生的逻辑推理能力合整体思维能力,解题时用到的信息并不一定是按题中的顺序进行,而是要善于归纳,整合思维,通盘考虑,寻找突破口,题目难度中等.

练习册系列答案
 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
下列物质中,属于乙醇同系物的是( )
A、 |
B、 |
| C、CH2OHCH2OH |
| D、(CH3)2CHOH |
下列比较错误的是( )
| A、密度:1-溴甲烷<1-溴乙烷<1-溴丙烷 |
| B、等物质的量的醇与足量Na反应生成氢气的量:甲醇<乙二醇<丙三醇 |
| C、沸点:邻二甲苯>间二甲苯>对二甲苯 |
| D、在水中溶解性:乙醇>正丁醇>正十二醇 |
下列各种元素中,都属于短周期的是( )
| A、Li、Na、K |
| B、C、Si、P |
| C、Mg、Al、Fe |
| D、F、Cl、Br |
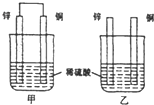 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.