题目内容
 铁、钴、镍为第四周期第Ⅷ族元素,它们的性质非常相似,也称为铁系元素.
铁、钴、镍为第四周期第Ⅷ族元素,它们的性质非常相似,也称为铁系元素.(1)铁、钴、镍都是很好的配位化合物形成体.
①[Co(H2O)6]2+在过量氨水中易转化为[Co(NH3)6]2+.写出Co2+的价层电子排布图
②铁、镍易与一氧化碳作用形成羰基配合物,如:Fe(CO)5,Ni(CO)4等.CO与N2属于等电子体,则CO分子中σ键和π键数目比为
(2)+2价和+3价是Fe、Co、Ni等元素常见化合价.NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和F22+的离子半径分别为69pm和78pm,则熔点NiO
考点:配合物的成键情况,共价键的形成及共价键的主要类型,判断简单分子或离子的构型,晶胞的计算
专题:化学键与晶体结构
分析:(1)①根据构造原理写出电子排布式,再画出价电子轨道排布图;根据配合物的化学式确定配离子和外界离子,根据配离子确定配体的数目,即配位数;根据价层电子对互斥理论确定分子的空间构型及原子杂化方式,价层电子对个数=σ键个数+孤电子对个数;
②CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,则C、O之间为三键,三键中含有1个σ键、2个π键,单键属于σ键;等电子体中原子数和价电子数都相同;
(2)离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高;根据物质中阴阳离子电荷总数相等计算Ni3+、Ni2+的个数比;
②CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,则C、O之间为三键,三键中含有1个σ键、2个π键,单键属于σ键;等电子体中原子数和价电子数都相同;
(2)离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高;根据物质中阴阳离子电荷总数相等计算Ni3+、Ni2+的个数比;
解答:
解:(1)①Co元素为27号元素,原子核外有27个电子,所以核外电子排布式为:1s22s22p63s23p63d74s2,Co2+3d轨道中有7个电子,且有3个单电子,其价电子轨道排布图为: ;
;
[Co(H2O)6]2+中配体为H2O,配合物的配位数为6;氨气中价层电子对个数=3+
×(5-3×1)=4且含有1个孤电子对,所以N原子采用sp3杂化;
H2O中O原子的价层电子对个数=2+
×(6-2×1)=4且含有2个孤电子对,所以O原子采用sp3杂化,其空间构型为V形结构;
故答案为: ;6;sp3;V形;
;6;sp3;V形;
②CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,则CO的结构式为C≡O,三键中含有1个σ键、2个π键,单键属于σ键,则CO分子中σ键和π键数目比为1:2,则 N2、CN-、CO的原子数都是2,价电子数都是10,则互为等电子体,
故答案为:1:2;CN-;
(2)Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,所以熔点是NiO>FeO;
设1mol Ni0.97O中含Ni3+xmol,Ni2+为(0.97-x)mol,根据晶体仍呈电中性,可知 3x+2×(0.97-x)=2×1,x=0.06mol Ni2+为(0.97-x)mol=0.91mol,即离子数之比为Ni3+:Ni2+=0.06:0.91=6:91;
故答案为:>;6:91;
 ;
;[Co(H2O)6]2+中配体为H2O,配合物的配位数为6;氨气中价层电子对个数=3+
| 1 |
| 2 |
H2O中O原子的价层电子对个数=2+
| 1 |
| 2 |
故答案为:
 ;6;sp3;V形;
;6;sp3;V形;②CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,则CO的结构式为C≡O,三键中含有1个σ键、2个π键,单键属于σ键,则CO分子中σ键和π键数目比为1:2,则 N2、CN-、CO的原子数都是2,价电子数都是10,则互为等电子体,
故答案为:1:2;CN-;
(2)Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,所以熔点是NiO>FeO;
设1mol Ni0.97O中含Ni3+xmol,Ni2+为(0.97-x)mol,根据晶体仍呈电中性,可知 3x+2×(0.97-x)=2×1,x=0.06mol Ni2+为(0.97-x)mol=0.91mol,即离子数之比为Ni3+:Ni2+=0.06:0.91=6:91;
故答案为:>;6:91;
点评:本题考查了基态原子的核外电子排布式、原子杂化方式、等电子体、晶胞的计算等知识点,为高频考点,侧重于基本概念的综合理解和运用的考查,明确晶胞中阴阳离子所带电荷相等是解本题的关键,题目难度中等.

练习册系列答案
相关题目
 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.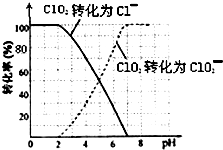 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.比Cl2更好.
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.比Cl2更好.