题目内容
下列操作中错误的是.( )
| A、除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯 |
| B、分离乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃):蒸馏 |
| C、取待测液与氢氧化钠共热,产生刺激性气体能使湿润的红色石蕊试纸变蓝,含NH4+ |
| D、分离溶解在水中的少量溴:加入CCl4,使用分液漏斗进行萃取 |
考点:化学实验方案的评价,物质的分离、提纯和除杂,物质的检验和鉴别的基本方法选择及应用
专题:实验评价题
分析:A.乙醇易溶于乙酸乙酯,且酯化反应为可逆反应;
B.乙酸与乙酸乙酯的沸点不同;
C.刺激性气体能使湿润的红色石蕊试纸变蓝,气体为氨气;
D.溴不易溶于水,易溶于有机溶剂.
B.乙酸与乙酸乙酯的沸点不同;
C.刺激性气体能使湿润的红色石蕊试纸变蓝,气体为氨气;
D.溴不易溶于水,易溶于有机溶剂.
解答:
解:A.乙醇易溶于乙酸乙酯,且酯化反应为可逆反应,则加乙醇不能除杂,应加饱和碳酸钠溶液分液来除杂,故A错误;
B.乙酸与乙酸乙酯的沸点不同,则蒸馏可分离,故B正确;
C.刺激性气体能使湿润的红色石蕊试纸变蓝,气体为氨气,由N原子守恒可知,溶液中存在NH4+,故C正确;
D.溴不易溶于水,易溶于有机溶剂,则分离溶解在水中的少量溴:加入CCl4,使用分液漏斗进行萃取,故D正确;
故选A.
B.乙酸与乙酸乙酯的沸点不同,则蒸馏可分离,故B正确;
C.刺激性气体能使湿润的红色石蕊试纸变蓝,气体为氨气,由N原子守恒可知,溶液中存在NH4+,故C正确;
D.溴不易溶于水,易溶于有机溶剂,则分离溶解在水中的少量溴:加入CCl4,使用分液漏斗进行萃取,故D正确;
故选A.
点评:本题考查化学实验方案的评价,为高频考点,涉及混合物的分离提纯、有机物的结构与性质、离子检验等,把握物质的性质、发生的反应为解答的关键,侧重分离方法选择和实验技能的考查,题目难度不大.

练习册系列答案
相关题目
如图是某硫酸试剂瓶的标签上的部分信息.下列说法正确的是( )


| A、常温下,该试剂可与金属铝反应生成大量的无色气体 |
| B、1 mol Zn与足量的该硫酸反应生成2 g氢气 |
| C、该硫酸与等体积水混合所得溶液的物质的量浓度大于9.2 mol/L |
| D、向50 mL该硫酸中加入足量的铜片,加热,反应后被还原的硫酸的物质的量小于0.46 mol |
1mol某气态烃与5mol氧气在密闭容器中点燃,烃和氧气全部耗尽,测得生成4mol H2O(g)、2mol CO2和2mol CO(气体体积均在同温同压下测定)该烃的分子式是( )
| A、C4H10 |
| B、C3H8 |
| C、C4H8 |
| D、C2H4 |
对下列化学反应热现象,不正确的说法是( )
| A、放热的反应发生时不必加热 |
| B、化学反应一定有能量变化 |
| C、有些吸热反应不必加热也能发生 |
| D、化学反应热效应数值与反应物质多少有关 |
用下列方法制取氢气,反应速率最大的是( )
| A、10℃时,粉末状锌与2mol?L-1硫酸溶液反应 |
| B、30℃时,粉末状锌与2mol?L-1硫酸溶液反应 |
| C、10℃时,块状锌与2mol?L-1硫酸溶液反应 |
| D、30℃时,块状锌与2mol?L-1硫酸溶液反应 |
下列物质中,属于乙醇同系物的是( )
A、 |
B、 |
| C、CH2OHCH2OH |
| D、(CH3)2CHOH |
甲酸的下列性质中,可以证明它是弱电解质的是( )
| A、甲酸能与水以任意比互溶 |
| B、1mol/L甲酸溶液的PH约为2 |
| C、10mL1mol/L甲酸恰好与10mL1mol/LNaOH溶液完全反应 |
| D、在相同条件下,甲酸溶液的导电性比强酸溶液的弱 |
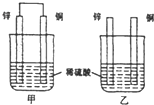 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.