题目内容
关于1mol H2O的叙述正确的是( )
| A、含有1mol氢气 |
| B、质量为18g/mol |
| C、在标准状况下的体积为22.4L |
| D、含有水分子的个数约为6.02×1023 |
考点:物质的量的相关计算
专题:计算题
分析:A.构成水分子的微粒是H原子和O原子;
B.根据m=nM计算其质量;
C.标况下水是液体,气体摩尔体积对其不适用;
D.根据N=nNA计算水分子个数.
B.根据m=nM计算其质量;
C.标况下水是液体,气体摩尔体积对其不适用;
D.根据N=nNA计算水分子个数.
解答:
解:A.构成水分子的微粒是H原子和O原子而不是氢气,所以水中不存在氢气,故A错误;
B.水的质量m=nM=1mol×18g/mol=18g,故B错误;
C.标况下水是液体,气体摩尔体积对其不适用,无法计算其体积,故C错误;
D.水分子个数N=nNA=1mol×NA/mol=6.02×1023,故D正确;
故选D.
B.水的质量m=nM=1mol×18g/mol=18g,故B错误;
C.标况下水是液体,气体摩尔体积对其不适用,无法计算其体积,故C错误;
D.水分子个数N=nNA=1mol×NA/mol=6.02×1023,故D正确;
故选D.
点评:本题考查了物质的量的有关计算,明确物质的构成及物质的量有关公式即可解答,注意气体摩尔体积的适用范围及适用条件,为易错点.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
1mol某气态烃与5mol氧气在密闭容器中点燃,烃和氧气全部耗尽,测得生成4mol H2O(g)、2mol CO2和2mol CO(气体体积均在同温同压下测定)该烃的分子式是( )
| A、C4H10 |
| B、C3H8 |
| C、C4H8 |
| D、C2H4 |
甲酸的下列性质中,可以证明它是弱电解质的是( )
| A、甲酸能与水以任意比互溶 |
| B、1mol/L甲酸溶液的PH约为2 |
| C、10mL1mol/L甲酸恰好与10mL1mol/LNaOH溶液完全反应 |
| D、在相同条件下,甲酸溶液的导电性比强酸溶液的弱 |
使用容量瓶配置溶液时,由于操作不当会引起误差,下列情况会使所配溶液浓度偏低的是( )
①用天平称量时所用砝码生锈
②用量筒量取所需浓溶液时,仰视刻度
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,俯视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线.
①用天平称量时所用砝码生锈
②用量筒量取所需浓溶液时,仰视刻度
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,俯视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线.
| A、②⑤ | B、②③⑥ |
| C、①⑤⑥ | D、③⑥ |
已知:C(s)+H2O(I)=CO(g)+H2(g)△H1═+175.3kJ/mol
CO(g)+
O2(g)═CO2(g)△H2═-283.0kJ/mol
H2(g)+
O2(g)═H2O(Ⅰ)△H3═-283.0kJ/mol
则C(s)+O2(g)═CO2(g)的△H等于( )
CO(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
则C(s)+O2(g)═CO2(g)的△H等于( )
| A、390.7kj/mol |
| B、-679.3kj/mol |
| C、-787kj/mol |
| D、+180.9kj/mol |
下列比较错误的是( )
| A、密度:1-溴甲烷<1-溴乙烷<1-溴丙烷 |
| B、等物质的量的醇与足量Na反应生成氢气的量:甲醇<乙二醇<丙三醇 |
| C、沸点:邻二甲苯>间二甲苯>对二甲苯 |
| D、在水中溶解性:乙醇>正丁醇>正十二醇 |
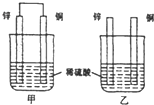 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.