题目内容
18.为探究元素性质递变规律,设计如下实验.(1)填写各实验步骤对应的实验现象(选填相应序号;不重复选).
| 实验序号 | 实验步骤 | 实验现象 |
| ① | 将一小块金属钠放入滴有酚酞溶液的冷水中. | B |
| ② | 将磨去表面氧化膜的一小段镁条放入试管中,加入2mL水,滴入2滴酚酞溶液,加热至水沸腾. | D |
| ③ | 将磨去表面氧化膜的一小段镁条投入2mL 1mol/L盐酸中. | A |
| ④ | 将磨去表面氧化膜的一小片铝投入2mL 1mol/L盐酸中. | C |
B.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色.
C.反应不十分剧烈;产生无色气体.
D.有气体产生,溶液变成浅红色.
(2)实验④:向1mL 1mol/L AlCl3溶液中滴加2mol/L NaOH溶液至过量,观察生成白色胶状沉淀,继而沉淀消失.
请用离子方程式解释该实验现象:Al3++3OH-═Al(OH)3↓;、Al(OH)3+OH-═AlO2-+2H2O
(3)实验⑤:在试管中加入3~5mL Na2SiO3溶液,逐滴加入稀硫酸,边加边振荡.观察试管中出现白色凝胶.相应化学方程式:H2SO4+Na2SiO3═H2SiO3(胶体)+Na2SiO4,证明酸性:H2SO4>H2SiO3(用化学式表示).
(4)实验⑥:向新制得的Na2S溶液中滴加新制的氯水.观察试管中出现黄色沉淀.相应离子方程式:S2-+Cl2═S↓+2Cl-,证明氧化性:Cl2>S(用化学式表示).
通过以上实验和讨论,推断钠、镁、铝的金属性逐渐减弱 (选填“增强”或“减弱”),硅、硫、氯的非金属性逐渐增强(选填“增强”或“减弱”).
分析 (1)金属钠和水之间反应生成氢氧化钠和氢气,现象:浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色;金属镁和沸水之间反应生成氢氧化镁和氢气;将磨去表面氧化膜的一小段镁条投入2mL 1mol/L盐酸中,金属镁和盐酸反应产生氯化镁和氢气;将磨去表面氧化膜的一小片铝投入2mL 1mol/L盐酸中会发生反应产生氯化铝和氢气,但是不如金属镁的反应速率快;
(2)氯化铝和少量的氢氧化钠之间反应生成白色沉淀氢氧化铝,氢氧化铝可以溶于过量的氢氧化钠得到偏铝酸钠溶液;
(3)Na2SiO3溶液中逐滴加入稀硫酸会发生反应得到硅酸沉淀和硫酸钠溶液;
(4)向新制得的Na2S溶液中滴加新制的氯水,会发生反应S2-+Cl2═S↓+2Cl-,氧化剂的氧化性大于氧化产物的氧化性,同周期元素从左到右金属性减弱,非金属性增强.
解答 解:(1)金属钠和水之间反应生成氢氧化钠和氢气,现象:浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色;金属镁和沸水之间反应生成氢氧化镁和氢气,反应中加酚酞后现象:有气体产生,溶液变成浅红色;将磨去表面氧化膜的一小段镁条投入2mL 1mol/L盐酸中,金属镁和盐酸反应产生氯化镁和氢气,即剧烈反应,迅速产生大量无色气体;将磨去表面氧化膜的一小片铝投入2mL 1mol/L盐酸中会发生反应产生氯化铝和氢气,但是不如金属镁的反应速率快,即反应不十分剧烈;产生无色气体;
故答案为:
| 实验序号 | 实验现象 |
| ① | B |
| ② | D |
| ③ | A |
| ④ | C |
(3)Na2SiO3溶液中逐滴加入稀硫酸会发生反应得到硅酸沉淀和硫酸钠溶液,即H2SO4+Na2SiO3═H2SiO3(胶体)+Na2SiO4; 反应遵循强酸制得弱酸的规律,即酸性:H2SO4>H2SiO3;故答案为:H2SO4+Na2SiO3═H2SiO3(胶体)+Na2SiO4; H2SO4>H2SiO3;
(4)向新制得的Na2S溶液中滴加新制的氯水,会发生反应S2-+Cl2═S↓+2Cl-,氧化剂的氧化性大于氧化产物的氧化性,即Cl2>S,同周期元素从左到右金属性减弱,非金属性增强,所以钠、镁、铝的金属性逐渐减弱,硅、硫、氯的非金属性逐渐增强.
故答案为:S2-+Cl2═S↓+2Cl-;Cl2>S;减弱;增强.
点评 本题通过实验探究得到:同周期元素从左到右金属性减弱,非金属性增强的规律,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
8.科技改变生活,充电宝已逐渐成为人们生活中的必需品.某充电宝工作时的总反应式为:V2O3+xLi $?_{充电}^{放电}$ Li4V2O3,下列说法正确的是( )
| A. | 放电时正极上的电极反应为:Li-e-═Li+ | |
| B. | 该充电宝的凝胶介质可用KOH水溶液代替 | |
| C. | 充电时每生成14g Li,凝胶介质中有2mol电子通过 | |
| D. | 充电时电池的正极失电子后Li4V2O3会转化为V2O3 |
6. 韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视. 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示.下列说法正确的是( )
韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视. 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示.下列说法正确的是( )
 韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视. 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示.下列说法正确的是( )
韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视. 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示.下列说法正确的是( )| A. | N极为电源负极,联氨从c口通入 | |
| B. | 负极上每消耗lmol N2H4,转移6mol电子 | |
| C. | 正极的电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 可将联氨改进为引火性低、稳定性好的N2H4•H2O |
13.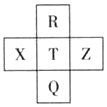 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | T的单质在化学反应中只表现氧化性 | |
| B. | R与Q的电子数相差16 | |
| C. | T形成的含氧酸的酸性一定比X形成的含氧酸强 | |
| D. | 在这五种元素中Z的化学性质最稳定 |
10.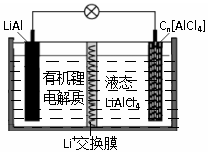 某种新型电池的工作原理如图”所示.Cn为石墨烯,液态LiAlCl4中含有Li+和AlCl4-.下列说法正确的是( )
某种新型电池的工作原理如图”所示.Cn为石墨烯,液态LiAlCl4中含有Li+和AlCl4-.下列说法正确的是( )
 某种新型电池的工作原理如图”所示.Cn为石墨烯,液态LiAlCl4中含有Li+和AlCl4-.下列说法正确的是( )
某种新型电池的工作原理如图”所示.Cn为石墨烯,液态LiAlCl4中含有Li+和AlCl4-.下列说法正确的是( )| A. | 充电时,Cn为阳极,电极反应为:Cn+AlCl4--e-═Cn[AlCl4] | |
| B. | 放电时,当电路中通过0.1mol电子时,有0.1molLi+通过交换膜向LiAl极移动 | |
| C. | LiAl具有强氧化性,放电时作负极材料 | |
| D. | 电池中可能发生副反应:2Al+6H2O═2Al(OH)3+3H2↑,故该电池存在安全隐患 |
7.四种主族元素a、b、c、d分布在三个短周期中,其原子序数依次增大,b、d的简单离子具有相同电子层结构,d的简单离子半径是同周期主族元素中最小的,四种元素原子的最外层电子数之和为15,下列叙述错误的是( )
| A. | 气态氢化物的热稳定性:b<c | B. | 含d元素的盐溶液可能呈碱性 | ||
| C. | 原子半径:d>c>b>a | D. | a、b和c三种元素能形成离子化合物 |
20.酸雨的pH值是( )
| A. | <7 | B. | <6.5 | C. | <6 | D. | <5.6 |

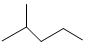 表示的分子式C6H14;系统命名法的名称是2-甲基戊烷.
表示的分子式C6H14;系统命名法的名称是2-甲基戊烷.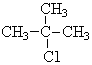 .
.