题目内容
6. 韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视. 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示.下列说法正确的是( )
韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视. 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示.下列说法正确的是( )| A. | N极为电源负极,联氨从c口通入 | |
| B. | 负极上每消耗lmol N2H4,转移6mol电子 | |
| C. | 正极的电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 可将联氨改进为引火性低、稳定性好的N2H4•H2O |
分析 根据氢离子得移动方向,电极N为正极,电极M为负极,燃料电池的负极为联氨发生氧化反应,电极反应式为:N2H4-4e-=N2↑+4H+,正极是氧气发生还原反应,电极反应式为:O2+4H++4e-═2H2O,据此分析解答.
解答 解:A、根据氢离子得移动方向,电极N为正极,正极是氧气发生还原反应,则氧气从c口通入,故A错误;
B、负极为联氨发生氧化反应,电极反应式为:N2H4-4e-=N2↑+4H+,则每消耗lmol N2H4,转移4mol电子,故B错误;
C、正极是氧气发生还原反应,电极反应式为:O2+4H++4e-═2H2O,故C错误;
D、将联氨改进为引火性低、稳定性好的N2H4•H2O,则电池的安全性会更高,故D正确;
故选D.
点评 本题考查了燃料电池,为高频考点,侧重于学生的分析的考查,题目涉及电极反应式以及电池反应方程式书写,题目难度较大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.下列有关实验原理或操作不正确的是( )
| A. | 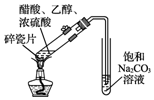 用图装置制取少量乙酸乙酯 | |
| B. | 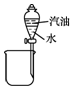 用图装置分离汽油和水 | |
| C. | 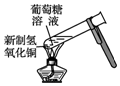 用图装置验证葡萄糖的还原性 | |
| D. | 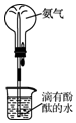 用图装置验证氨气的溶解性和氨水的碱性 |
14.常温下,一定浓度的某酸HA溶液的pH=5,下列有关说正确的是( )
| A. | 向溶液中加入适量NaA固体,若溶液pH不变,则HA为强酸 | |
| B. | 若HA为弱酸,则该溶液导电能力比等体积pH=5的盐酸弱得多 | |
| C. | 若HA为弱酸,则加入等体积pH=9的NaOH溶液,所得溶液pH>7 | |
| D. | 取该溶液1.00mL,加水稀释至1000mL,所得溶液pH=8 |
1.化合物乙是一种治疗神经类疾病的药物,可由化合物甲经多步反应得到.下列有关甲、乙的说法正确的是( )
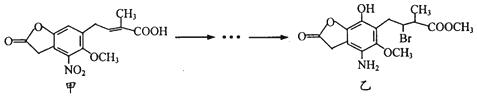

| A. | 甲的分子式为C14H14NO7 | |
| B. | 甲、乙中各有1个手性碳原子 | |
| C. | 可用NaHCO3溶液或FeCl3溶液鉴别化合物甲、乙 | |
| D. | 乙能与盐酸、NaOH溶液反应,且lmol乙最多能与4 mol NaOH反应 |
11. 短周期元素X、Y、Z,原子序数之和为16,原子半径的大小关系为:r(Y)>r(X)>r(Z),X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子.下列说法正确的是( )
短周期元素X、Y、Z,原子序数之和为16,原子半径的大小关系为:r(Y)>r(X)>r(Z),X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子.下列说法正确的是( )
 短周期元素X、Y、Z,原子序数之和为16,原子半径的大小关系为:r(Y)>r(X)>r(Z),X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子.下列说法正确的是( )
短周期元素X、Y、Z,原子序数之和为16,原子半径的大小关系为:r(Y)>r(X)>r(Z),X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子.下列说法正确的是( )| A. | Y元素位于ⅥA族 | B. | A、B、C都是非电解质 | ||
| C. | C的沸点高于B的沸点 | D. | A和C可发生氧化还原反应 |
18.为探究元素性质递变规律,设计如下实验.
(1)填写各实验步骤对应的实验现象(选填相应序号;不重复选).
A.剧烈反应,迅速产生大量无色气体.
B.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色.
C.反应不十分剧烈;产生无色气体.
D.有气体产生,溶液变成浅红色.
(2)实验④:向1mL 1mol/L AlCl3溶液中滴加2mol/L NaOH溶液至过量,观察生成白色胶状沉淀,继而沉淀消失.
请用离子方程式解释该实验现象:Al3++3OH-═Al(OH)3↓;、Al(OH)3+OH-═AlO2-+2H2O
(3)实验⑤:在试管中加入3~5mL Na2SiO3溶液,逐滴加入稀硫酸,边加边振荡.观察试管中出现白色凝胶.相应化学方程式:H2SO4+Na2SiO3═H2SiO3(胶体)+Na2SiO4,证明酸性:H2SO4>H2SiO3(用化学式表示).
(4)实验⑥:向新制得的Na2S溶液中滴加新制的氯水.观察试管中出现黄色沉淀.相应离子方程式:S2-+Cl2═S↓+2Cl-,证明氧化性:Cl2>S(用化学式表示).
通过以上实验和讨论,推断钠、镁、铝的金属性逐渐减弱 (选填“增强”或“减弱”),硅、硫、氯的非金属性逐渐增强(选填“增强”或“减弱”).
(1)填写各实验步骤对应的实验现象(选填相应序号;不重复选).
| 实验序号 | 实验步骤 | 实验现象 |
| ① | 将一小块金属钠放入滴有酚酞溶液的冷水中. | B |
| ② | 将磨去表面氧化膜的一小段镁条放入试管中,加入2mL水,滴入2滴酚酞溶液,加热至水沸腾. | D |
| ③ | 将磨去表面氧化膜的一小段镁条投入2mL 1mol/L盐酸中. | A |
| ④ | 将磨去表面氧化膜的一小片铝投入2mL 1mol/L盐酸中. | C |
B.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色.
C.反应不十分剧烈;产生无色气体.
D.有气体产生,溶液变成浅红色.
(2)实验④:向1mL 1mol/L AlCl3溶液中滴加2mol/L NaOH溶液至过量,观察生成白色胶状沉淀,继而沉淀消失.
请用离子方程式解释该实验现象:Al3++3OH-═Al(OH)3↓;、Al(OH)3+OH-═AlO2-+2H2O
(3)实验⑤:在试管中加入3~5mL Na2SiO3溶液,逐滴加入稀硫酸,边加边振荡.观察试管中出现白色凝胶.相应化学方程式:H2SO4+Na2SiO3═H2SiO3(胶体)+Na2SiO4,证明酸性:H2SO4>H2SiO3(用化学式表示).
(4)实验⑥:向新制得的Na2S溶液中滴加新制的氯水.观察试管中出现黄色沉淀.相应离子方程式:S2-+Cl2═S↓+2Cl-,证明氧化性:Cl2>S(用化学式表示).
通过以上实验和讨论,推断钠、镁、铝的金属性逐渐减弱 (选填“增强”或“减弱”),硅、硫、氯的非金属性逐渐增强(选填“增强”或“减弱”).
15.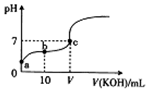 已知25℃时CH3COOH的电离常数K=1.6×10-5.该温度下向20ml 0.01mol•L-1 CH3COOH溶液中逐滴加入0.01mol•L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化),下列有关叙述正确的是 ( )
已知25℃时CH3COOH的电离常数K=1.6×10-5.该温度下向20ml 0.01mol•L-1 CH3COOH溶液中逐滴加入0.01mol•L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化),下列有关叙述正确的是 ( )
 已知25℃时CH3COOH的电离常数K=1.6×10-5.该温度下向20ml 0.01mol•L-1 CH3COOH溶液中逐滴加入0.01mol•L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化),下列有关叙述正确的是 ( )
已知25℃时CH3COOH的电离常数K=1.6×10-5.该温度下向20ml 0.01mol•L-1 CH3COOH溶液中逐滴加入0.01mol•L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化),下列有关叙述正确的是 ( )| A. | a点溶液中c(H+)为4.0×10-5mol/L | |
| B. | c点溶液中的离子浓度大小顺序为c(K+)>c(CH3COO-)>c(H+)=c(OH-) | |
| C. | V=20 | |
| D. | a、b、c三点中水的电离程度最大的是c点 |
8.已知W、X、Y、Z为短周期元素,它们的原子半径依次增大,W和Z、X和Y分别同主族,Y、Z同周期.Z能与X形成两种常见的离子化合物,离子个数比均为2:1.下列说法错误的是( )
| A. | Z、Y、X、W的原子序数依次减小 | |
| B. | W与X可形成既含极性共价键又含非极性共价键的化合物 | |
| C. | Z的最高价氧化物对应的水化物是短周期元素形成的最强碱 | |
| D. | X的简单氢化物的沸点低于Y的简单氢化物的沸点 |
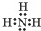 .
.