题目内容
5.在NaCl溶液中滴加AgNO3溶液,反应的离子方程式为:Cl-+Ag+=AgCl↓.分析 在NaCl溶液中滴加AgNO3溶液,氯化钠与硝酸银反应生成氯化银沉淀和硝酸钠,据此书写离子方程式.
解答 在NaCl溶液中滴加AgNO3溶液,氯化钠与硝酸银反应生成氯化银沉淀和硝酸钠,反应实质是银离子与氯离子生成氯化银沉淀,离子方程式:Cl-+Ag+=AgCl↓,
故答案为:Cl-+Ag+=AgCl↓.
点评 本题考查了离子方程式的书写,熟悉离子反应条件即可解答,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
11.下列实验操作与实验目的都正确的是( )
| 实验操作 | 实验目的 | |
| A | 制乙炔时用饱和食盐水代替水 | 加快化学反应速率 |
| B | CH4与SO2混合气体通过盛有溴水的洗气瓶 | 除去中CH4的SO2 |
| C | 甲烷与乙烯的混合气体通过盛有酸性高锰酸钾的洗气瓶 | 除去甲烷中的乙烯 |
| D | 将浓硫酸、乙醇混合加入试管中,加热,然后将导管末端插入酸性KMnO4溶液中,观察现象; | 检验是否有乙烯生成 |
| A. | A | B. | B | C. | C | D. | D |
13. 实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应.
实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应.
按要求回答下列问题:
(1)欲用如图装置来比较该反应的反应速率快慢,如何检查装置气密性:将注射器活塞向外拉出一段,过一会后活塞回到原位,说明气密性良好.
(2)当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测相同时间内收集的气体体积或收集相同体积的气体需要的时间计算反应速率.
(3)为实现实验目的,则V1=20.0,V2=20.0;V3=10.0,V4=5.0.
(4)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是C(填“实验编号”)
(5)已知Fe3+催化H2O2分解的机理可分两步反应进行,其中第一步反应为:2Fe3++H2O2═2Fe2++O2↑+2H+,则第二步反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O.
 实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应.
实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应.| 实验编号 试剂 | A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/mL | 0 | 5.0 | 10.0 |
| H2O/mL | V3 | V4 | 0 |
(1)欲用如图装置来比较该反应的反应速率快慢,如何检查装置气密性:将注射器活塞向外拉出一段,过一会后活塞回到原位,说明气密性良好.
(2)当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测相同时间内收集的气体体积或收集相同体积的气体需要的时间计算反应速率.
(3)为实现实验目的,则V1=20.0,V2=20.0;V3=10.0,V4=5.0.
(4)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是C(填“实验编号”)
(5)已知Fe3+催化H2O2分解的机理可分两步反应进行,其中第一步反应为:2Fe3++H2O2═2Fe2++O2↑+2H+,则第二步反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O.
10.下列表述错误的是( )
| A. | 氢氧根离子的电子式是: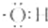 | B. | 甲烷分子的比例模型是: | ||
| C. | 硝基的表示方法-NO2 | D. | 饱和烃的通式是CnH2n+2(n≥1) |
14.下列表示对应化学反应的离子方程式正确的是( )
| A. | 大理石与盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 将过量SO2通入冷氨水中:SO2+NH3•H2O=HSO3-+NH4+ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
15.一定条件下,可逆反应X(g)+3Y(g)?2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol•L-1、0.3mol•L-1、0.08mol•L-1,则下列判断正确的是( )
| A. | c1:c2的值不能确定 | |
| B. | 平衡时,Y和Z的生成速率之比为1:1 | |
| C. | 0.48mol•L-1<c1+c2+c3<0.56mol•L-1 | |
| D. | c1的取值范围为0<c1<0.14 mol•L-1 |
 甲烷可用氧化铁作催化剂实现选择性地催化脱硝.
甲烷可用氧化铁作催化剂实现选择性地催化脱硝.
 .
.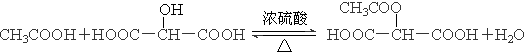 .
.
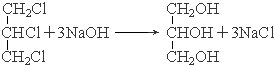 .
.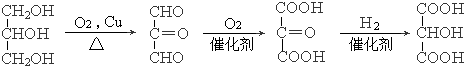 .
.