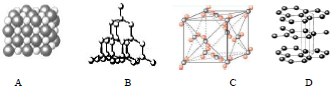
题目内容
11.下列实验操作与实验目的都正确的是( )| 实验操作 | 实验目的 | |
| A | 制乙炔时用饱和食盐水代替水 | 加快化学反应速率 |
| B | CH4与SO2混合气体通过盛有溴水的洗气瓶 | 除去中CH4的SO2 |
| C | 甲烷与乙烯的混合气体通过盛有酸性高锰酸钾的洗气瓶 | 除去甲烷中的乙烯 |
| D | 将浓硫酸、乙醇混合加入试管中,加热,然后将导管末端插入酸性KMnO4溶液中,观察现象; | 检验是否有乙烯生成 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.将食盐水中水作溶质、食盐作溶剂,则食盐水中水的浓度降低,浓度越低,反应速率越慢;
B.二氧化硫具有还原性,能和溴发生氧化还原反应,甲烷和溴不反应;
C.高锰酸钾与乙烯发生氧化还原反应生成二氧化碳气体;
D.乙醇能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色.
解答 解:A.将食盐水中水作溶质、食盐作溶剂,则食盐水中水的浓度降低,浓度越低,反应速率越慢,所以用饱和食盐水代替水而减缓电石制取乙炔的反应速率,故A错误;
B.二氧化硫具有还原性,能和溴发生氧化还原反应生成硫酸和氢溴酸,甲烷和溴不反应,所以可以用溴水除去甲烷中二氧化硫,故B正确;
C.高锰酸钾与乙烯发生氧化还原反应生成二氧化碳气体,引入新的杂质,故C错误;
D.乙醇能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,乙醇具有挥发性,制取的乙烯中含有乙醇,要检验乙烯的生成应该先用水除去乙醇,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高考高频点,涉及物质检验、反应速率的影响因素等知识点,明确实验原理是解本题关键,A采用逆向思维方法判断,注意C高锰酸钾与乙烯发生氧化还原反应生成二氧化碳气体,注意D中乙醇的干扰,这些都是易错点.

练习册系列答案
相关题目
1.下列有机化合物的一氯取代物的同分异构体的数目相等的是( )


| A. | ①② | B. | ②④ | C. | ③④ | D. | ①④ |
16.已知A、B、C、D的原子序数都不超过18,它们的离子aAm+、bBn+、cCm-、dDn- (m>n)均具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子序数:a>b>c>d | |
| B. | 离子半径:aAm+>bBn+>cCm->dDn- | |
| C. | 离子还原性:aA(n+1)+>bBn+,离子氧化性:cCm->dDn- | |
| D. | 单质还原性:B>A,单质氧化性:D>C |
3.下列说法不正确的是( )
| A. | Penguinone分子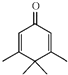 所有碳原子不可能都在同一个平面上 所有碳原子不可能都在同一个平面上 | |
| B. | 1mol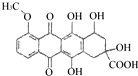 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为5 mol、3 mol、1 mol 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为5 mol、3 mol、1 mol | |
| C. | 醋酸和软脂酸互为同系物,C5H12和C9H20也一定互为同系物 | |
| D. | 蛋白质遇到醋酸铅生成沉淀,加入大量的水,沉淀还可溶解 |
20.下列各项中,表达正确的是( )
| A. | O原子的结构示意图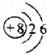 | B. | CH4分子的比例模型 | ||
| C. | C2H2分子的结构式CH≡CH | D. | N2分子的电子式 |
 .有机物X的键线式为
.有机物X的键线式为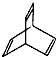
 .
.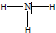 .
.