题目内容
10.下列表述错误的是( )| A. | 氢氧根离子的电子式是: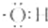 | B. | 甲烷分子的比例模型是: | ||
| C. | 硝基的表示方法-NO2 | D. | 饱和烃的通式是CnH2n+2(n≥1) |
分析 A.氢氧根离子为阴离子,根据阴离子的电子式的表示方法进行判断;
B.图示为甲烷的比例模型;
C.硝基为硝酸脱去羟基后生成的原子团;
D.烷烃中各个碳原子都处于饱和状态.
解答 解:A.氢氧根离子带有1个单位负电荷,氧原子最外层达到8电子稳定结构,氢氧根离子的电子式为: ,故A错误;
,故A错误;
B. 为甲烷的比例模型,故B正确;
为甲烷的比例模型,故B正确;
C.硝基为硝酸脱去羟基后生成的原子团,硝基的结构简式为:-NO2,故C正确;
D.分子通式为CnH2n+2的烃,C处于饱和状态,属于烷烃,故D正确;
故选:A.
点评 本题考查了电子式、比例模型、结构简式、有机物的通式,侧重考查学生对常用化学用语的熟练程度,题目难度中等,注意掌握常见化学用语的概念及正确的表示方法,明确球棍模型与比例模型的表示方法及区别.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.已知A、B、C、D的原子序数都不超过18,它们的离子aAm+、bBn+、cCm-、dDn- (m>n)均具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子序数:a>b>c>d | |
| B. | 离子半径:aAm+>bBn+>cCm->dDn- | |
| C. | 离子还原性:aA(n+1)+>bBn+,离子氧化性:cCm->dDn- | |
| D. | 单质还原性:B>A,单质氧化性:D>C |
2.已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$的值与温度高低有关.当n(KOH)=a mol时,下列有关说法错误的是( )
| A. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{O}_{3}^{-})}$=$\frac{1}{2}$ | |
| B. | 参加反应的氯气的物质的量等于$\frac{1}{2}$ a mol | |
| C. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$ a mol≤ne≤$\frac{5}{6}$ a mol | |
| D. | 改变温度,产物中KClO3的最大理论产量为$\frac{1}{7}$a mol |
19.有A、B两种烃,含碳的质量分数相同,下列关于A和B的叙述中正确的是( )
| A. | A和B不可能是同系物 | |
| B. | A和B一定是同分异构体 | |
| C. | A和B最简式一定相同 | |
| D. | 等物质的量的A和B完全燃烧生成等质量的CO2 |
20.下列叙述正确的是( )
| A. | 同周期元素的原子半径以ⅦA族的为最大 | |
| B. | 短周期中次外层电子数是最外层电子数2倍的原子一定是非金属元素 | |
| C. | 同主族两种元素原子的核外电子数的差值可能为26 | |
| D. | 科学家在周期表中金属元素与非金属元素分界线处找到了优良的催化剂 |
 某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:
某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下: