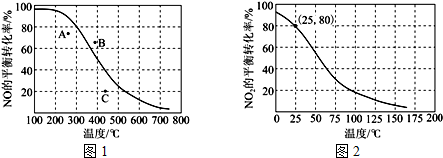
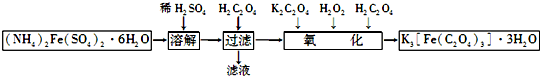
题目内容
4.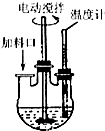 实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.
实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.已知:①I2+Na2CO3═NaI+NaIO+CO2↑;△H<0
3I2+3Na2CO3═5NaI+NaIO3+3CO2↑;△H<0
②I2(s)+I-(aq)═I3-(aq);
③水合肼(N2H4•H2O)具有强还原性,可分别将IO-、IO3-和I2还原为I-,本身被氧化为N2(放热反应);100℃左右水合肼分解为氮气和氨气等.
(1)常温常压时,I2与Na2CO3溶液反应很慢,下列措施能够加快反应速率的是abc(填字母).
a.将碘块研成粉末 b.起始时加少量NaI
c.将溶液适当加热 d.加大高纯水的用量
(2)I2与Na2CO3溶液反应适宜温度为40~70℃,温度不宜超过70℃,除防止反应速率过快,另一个原因是防止碘升华.
(3)加入稍过量水合肼发生反应的离子方程式为2IO-+N2H4+H2O=2I-+N2+3H2O(只写一个).
(4)整个实验过程中都需要开动搅拌器,其目的是使得合成反应均匀进行,并使产生的二氧化碳、氮气等气体及时排除.
(5)反应的后期I2与Na2CO3溶液反应难以进行,此阶段需对投料顺序作适当改进,改进的方法是先加入碘、水合肼,最后加入碳酸钠.
(6)所得溶液(偏黄,且含少量SO42-,极少量的K+和Cl-)进行脱色、提纯并结晶,可制得高纯NaI晶体.实验方案为:在溶液中加入少量活性炭煮沸、趁热过滤将滤液在不断搅拌下依次加入稍过量的氢氧化钡、碳酸钠溶液,过滤,滤液中在不断搅拌下加入HI溶液至使用pH试纸测定溶液的pH大约为6,蒸发冷却结晶,再次过滤,用高纯度的水洗涤晶体2-3次,在真空干燥箱中干燥
(实验中需使用的试剂有:HI溶液,Na2CO3溶液、Ba(OH)2溶液、高纯水及pH试纸;除常用仪器外须使用的仪器有:真空干燥箱).
分析 (1)加快反应速率的外因:温度、浓度,固体的表面积和催化剂等,据此回答;
(2)碘单质受热易升华,据此回答;
(3)NaIO在水溶液中可以和肼发生氧化还原反应,据此书写方程式;
(4)搅拌器的搅拌作用可以使混合物均匀混合,将产生的气体及时的排出;
(5)I2与Na2CO3溶液反应需要一定的环境,注意控制反应物的加入顺序;
(6)制得高纯NaI晶体,首先进行除杂,最后进行蒸发结晶洗涤干燥操作来分离和提纯物质即可.
解答 解:(1)a.将碘块研成粉末,增加接触面积,可以加快反应速率,故正确;
b.起始时加少量NaI,可以起到催化剂的作用,加快反应速率,故正确;
c.将溶液适当加热可以加快反应速率,故正确;
d.加大高纯水的用量,降低浓度会降低反应速率,故错误,
故选abc;
(2)I2与Na2CO3溶液反应适宜温度为40~70℃,温度不宜超过70℃,这样可以防止碘单质受热易升华,故答案为:防止碘升华;
(3)NaIO在水溶液中可以和肼发生氧化还原反应生成NaI、氮气和水,即2IO-+N2H4+H2O=2I-+N2+3H2O,故答案为:2IO-+N2H4+H2O=2I-+N2+3H2O;
(4)结合搅拌器的搅拌作用,整个实验过程中都需要开动搅拌器,其目的是可以使混合物均匀混合,将产生的气体及时的排出,故答案为:使得合成反应均匀进行,并使产生的二氧化碳、氮气等气体及时排除;
(5)根据反应:I2+Na2CO3═NaI+NaIO+CO2↑;△H<0,3I2+3Na2CO3═5NaI+NaIO3+3CO2↑;△H<0,后期I2与Na2CO3溶液反应难以进行,碘单质的浓度减小导致的,此阶段可以先加入碘、水合肼,最后加入碳酸钠,故答案为:先加入碘、水合肼,最后加入碳酸钠;
(6)所得溶液含少量SO42-,极少量的K+和Cl-,首先除杂,依次加入稍过量的氢氧化钡、碳酸钠溶液,过滤,然后,调整溶液的酸碱性,进行蒸发结晶操作,进行物质的分离和提纯,即趁热过滤将滤液在不断搅拌下依次加入稍过量的氢氧化钡、碳酸钠溶液,过滤,滤液中在不断搅拌下加入HI溶液至使用pH试纸测定溶液的pH大约为6,蒸发冷却结晶,再次过滤,用高纯度的水洗涤晶体2-3次,在真空干燥箱中干燥,
故答案为:趁热过滤将滤液在不断搅拌下依次加入稍过量的氢氧化钡、碳酸钠溶液,过滤,滤液中在不断搅拌下加入HI溶液至使用pH试纸测定溶液的pH大约为6,蒸发冷却结晶,再次过滤,用高纯度的水洗涤晶体2-3次,在真空干燥箱中干燥.
点评 本题综合考查学生物质的分离和提纯等化学实验方案设计知识,注意知识的迁移应用是关键,难度较大.

 名校课堂系列答案
名校课堂系列答案| A. | 碳酸的电离子方程式:H2CO3═2H++CO32- | |
| B. | 过量铁粉与稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 次氯酸钠溶液中滴入浓盐酸产生Cl2:2H++Cl-+ClO-═Cl2↑+H2O | |
| D. | (NH4)2Fe(SO4)2溶液中加入过量NaOH溶液并加热:NH4++Fe2++3OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+Fe(OH)2↓+H2O |
| A. | 原电池中阴离子向正极移动 | |
| B. | 原电池是将电能转化为化学能的装置 | |
| C. | 原电池中电子流出的极为负极,发生氧化反应 | |
| D. | 原电池正极上发生氧化反应 |