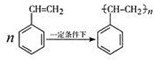
题目内容
11.从平时学生实验中我们发现,同学们在进行实验时出现许多不正确的操作方式,希望同学们在今后的实验中,应该克服不规范的操作.请找出下列图示中正确的实验操作( )| A. | 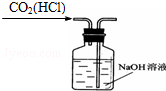 除去CO2中的HCl | B. | 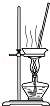 蒸发氯化钠溶液 | ||
| C. | 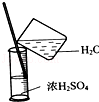 稀释浓硫酸 | D. | 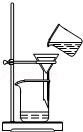 过滤 |
分析 A.二者均与NaOH溶液反应;
B.NaCl为可溶性固体;
C.量筒中不能稀释溶液;
D.过滤需要玻璃棒引流.
解答 解:A.二者均与NaOH溶液反应,不能除杂,应选饱和碳酸氢钠溶液除杂,故A错误;
B.NaCl为可溶性固体,则利用蒸发操作可得到NaCl,故B正确;
C.量筒中不能稀释溶液,应在烧杯中稀释、冷却,故C错误;
D.过滤需要玻璃棒引流,图中缺少玻璃棒,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、实验基本操作等,把握实验操作、反应原理、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
1.I2在KI溶液中存在下列平衡:I2 (aq)+I-(aq)?I3-(aq).测得不同温度下该反应的平衡常数如下表:( )
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1100 | 841 | 689 | 533 | 409 |
| A. | 反应I2 (aq)+I-(aq)?I3-(aq)的△H>0 | |
| B. | 其他条件不变,升高温度,溶液中c(I3-)减小 | |
| C. | 在上述平衡体系中加入苯,平衡不移动 | |
| D. | 25℃时向溶液中加入少量KI固体,平衡常数K大于689 |
19.Na和Na+两种粒子中,不相同的是( )
①核内质子数
②最内层电子数
③最外层电子数
④核外电子层数.
①核内质子数
②最内层电子数
③最外层电子数
④核外电子层数.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②③④ |
6.下列说法正确的是( )
| A. | 在常温常压下,11.2LN2所含有的分子数为0.5NA | |
| B. | 在标准状况下,22.4 L CO和N2的混合物的物质的量为1mol | |
| C. | 在标准状况下,18g H2O的体积为22.4 L | |
| D. | 1mol SO2中原子数为NA个 |
16.800℃时,a、b、c三种气态物的浓度随时间变化的情况如图,由图分析不能得出的结论是( )

| A. | a是反应物 | B. | 正反应是一个体积扩大的反应 | ||
| C. | 正反应是放热反应 | D. | 若增大压强,平衡逆向移动 |
20.将电解质分为强、弱电解质的依据是( )
| A. | 在一定条件下的电离程度 | B. | 属于离子化合物还是共价化合物 | ||
| C. | 熔融状态下是否完全电离 | D. | 溶于水后的导电能力是强还是弱 |
1.某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后pH大于7,下表中判断合理的是( )
| 标号 | HX | YOH | 溶液的体积关系 |
| ① | 强酸 | 强碱 | V(HX)=V(YOH) |
| ② | 强酸 | 强碱 | V(HX)<V(YOH) |
| ③ | 弱酸 | 弱碱 | V(HX)=V(YOH) |
| ④ | 弱酸 | 强碱 | V(HX)=V(YOH) |
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
 制取 聚苯乙烯
制取 聚苯乙烯