题目内容
6.下列说法正确的是( )| A. | 在常温常压下,11.2LN2所含有的分子数为0.5NA | |
| B. | 在标准状况下,22.4 L CO和N2的混合物的物质的量为1mol | |
| C. | 在标准状况下,18g H2O的体积为22.4 L | |
| D. | 1mol SO2中原子数为NA个 |
分析 A、常温常压下,气体摩尔体积大于22.4L/mol;
B、在标况下,任何气体的气体摩尔体积均为22.4L/mol;
C、标况下水为液态;
D、二氧化硫为三原子分子.
解答 解:A、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氮气的物质的量小于0.5mol,则分子数小于0.5NA个,故A错误;
B、在标况下,任何气体的气体摩尔体积均为22.4L/mol,故22.4LCO和氮气的混合物的物质的量为1mol,与两者的比例无关,故B正确;
C、标况下水为液态,故不能根据气体摩尔体积来计算其体积,故C错误;
D、二氧化硫为三原子分子,故1mol二氧化硫中含3mol原子即3NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
16.乌洛托品在合成、医药、染料等工业中有广泛用途,其结构如图.下列说法正确的是( )
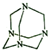

| A. | 分子式为N4C6 | B. | 分子中的氮原子全部是sp2杂化 | ||
| C. | 分子中共形成4个六元环 | D. | 分子间存在氢键 |
17.下列化学用语正确的是( )
| A. | 硅的原子结构示意图: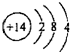 | |
| B. | 乙烯分子比例模型: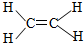 | |
| C. | 二氧化碳分子的电子式: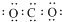 | |
| D. | 硫酸铁的电离方程式:Fe2(SO4)3═2Fe2++3SO42- |
14.下列有关离子方程错误的是( )
| A. | 将Fe加入CuSO4溶液中 Fe+Cu2+═Cu+Fe2+ | |
| B. | 向氯化铝溶液中加入足量氨水 Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| C. | 向Ca(OH)2溶液中通入过量 SO2SO2+OH-═HSO3- | |
| D. | 往水玻璃中加入盐酸 SiO32-+2H+═H2SiO3↓ |
1.下列物质属于酸的是( )
| A. | 二氧化硫 | B. | 生石灰 | C. | 三氧化硫 | D. | 硫酸 |
11.从平时学生实验中我们发现,同学们在进行实验时出现许多不正确的操作方式,希望同学们在今后的实验中,应该克服不规范的操作.请找出下列图示中正确的实验操作( )
| A. | 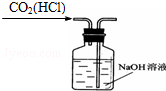 除去CO2中的HCl | B. | 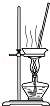 蒸发氯化钠溶液 | ||
| C. | 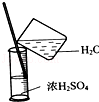 稀释浓硫酸 | D. | 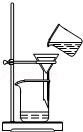 过滤 |
18.含有2~5个碳原子的直链烷烃沸点和燃烧热的数据见下表:
燃烧热:1mol物质完全燃烧,生成二氧化碳、液态水时所放出的热量.
根据表中数据,下列判断错误的是( )
| 烷烃名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 沸点/℃ | -88.6 | -42.1 | -0.5 | 36.1 |
| 燃烧热/KJ•mol-1 | 1559.8 | 2219.9 | 2877.6 | 3535.6 |
根据表中数据,下列判断错误的是( )
| A. | 正庚烷在常温常压下肯定不是气体 | |
| B. | 烷烃燃烧热和其所含碳原子数成线性关系 | |
| C. | 随碳原子数增加,烷烃沸点逐渐升高 | |
| D. | 随碳原子数增加,烷烃沸点和燃烧热都成比例增加 |
16. 某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).
某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).
实验记录如下:
请回答下列问题:
(1)A中反应的离子方程式是2Br-+Cl2=Br2+2Cl-.
(2)实验操作Ⅱ吹入热空气的目的是吹出单质Br2.
(3)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
(4)由上述实验得出的结论是氧化性:H2O2>Br2>H2SO3.
 某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).
某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).实验记录如下:
| 实验操作 | 实验现象 | |
| I | 打开活塞a,滴加氯水,关闭活塞a | A中溶液变为红棕色. |
| II | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化. |
| III | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色. |
(1)A中反应的离子方程式是2Br-+Cl2=Br2+2Cl-.
(2)实验操作Ⅱ吹入热空气的目的是吹出单质Br2.
(3)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
(4)由上述实验得出的结论是氧化性:H2O2>Br2>H2SO3.