题目内容
常温下Ksp(AgCl)=1.56×10-10,Ksp(AgI)=1.0×10-16,将等体积的AgCl和AgI的饱和溶液的清夜混合,再向其中加入一定量的AgNO3固体,下列说法正确的是( )
| A、两清夜混合,AgCl和AgI都沉淀 |
| B、向AgCl清夜加入AgNO3固体,c(Ag+)增大,Ksp(AgCl)也增大 |
| C、若AgNO3固体足量,AgCl和AgI都可沉淀,但以AgCl沉淀为主 |
| D、若取0.235克AgI固体放入100ml(忽略体积变化),c(I-)=0.01mol/l |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:计算混合后各离子浓度,根据溶度积判断沉淀的先后,溶度积小的沉淀先析出;温度不变,Ksp不变,据此分析.
解答:
解:A、饱和的AgCl溶液中:c(Ag+)=c(Cl-)=1.342×10-5,
饱和的AgI溶液中:c(Ag+)=c(I-)=1.0×10-8,
等体积混合后,浓度减半,c(Cl-)=6.71×10-6,c(I-)=5.0×10-9,c(Ag+)=6.71×10-6
明显,混合后,AgI必然沉淀,AgCl则不然.故A错误;
B、Ksp与温度有关,温度不变,Ksp不变,故B错误;
C、由于c(Cl-)》c(I-),若AgNO3固体足量,沉淀以AgCl为主,C正确;
D、常温下,1L饱和溶液中碘化银的质量为:1.0×10-8×235=2.35×10-6g,c(I-)=1.0×10-8mol/L,0.235克AgI固体放入100mL水,固体不能全部溶解,为饱和溶液,故c(I-)=1.0×10-8mol/L,故D错误;
故选C.
饱和的AgI溶液中:c(Ag+)=c(I-)=1.0×10-8,
等体积混合后,浓度减半,c(Cl-)=6.71×10-6,c(I-)=5.0×10-9,c(Ag+)=6.71×10-6
明显,混合后,AgI必然沉淀,AgCl则不然.故A错误;
B、Ksp与温度有关,温度不变,Ksp不变,故B错误;
C、由于c(Cl-)》c(I-),若AgNO3固体足量,沉淀以AgCl为主,C正确;
D、常温下,1L饱和溶液中碘化银的质量为:1.0×10-8×235=2.35×10-6g,c(I-)=1.0×10-8mol/L,0.235克AgI固体放入100mL水,固体不能全部溶解,为饱和溶液,故c(I-)=1.0×10-8mol/L,故D错误;
故选C.
点评:本题考查了溶度积常数的有关计算,题目难度中等,注意溶度积常数的大小与温度有关,侧重于考查学生对公式的应用能力和计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列关于有机物说法正确的是( )
| A、乙醇、乙醛和乙酸都可以与钠反应生成氢气 |
| B、蛋白质水解的最终产物是葡萄糖 |
| C、苯和乙烯都可以使溴的四氯化碳溶液反应褪色 |
| D、可用碘检验淀粉是否水解完全 |
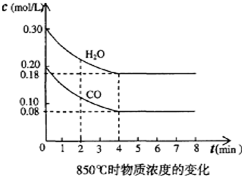 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g),△H<0.CO和H2O浓度变化如图,下列叙述错误的是( )
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g),△H<0.CO和H2O浓度变化如图,下列叙述错误的是( )| A、0一4min的平均反应速率υ(CO2)为0.03mol/(L?min) |
| B、850℃时,平衡常数K=1 |
| C、850℃时,若向该容器中充入1.0 mol CO、1.0 molH2O,则CO的平衡转化率不变 |
| D、容器中气体密度不变不能判断该反应已经达到化学平衡状态 |
海水中有丰富的矿产、能源、药物、水产等化学化工资源,下图是某工厂对海水资源综合利用的示意图.下列有关说法正确的是( )


| A、海水中含有丰富的常量元素Mg和Br,以及微量元素I |
| B、流程②为:将MgCl2?6H2O在空气中受热分解制无水MgCl2 |
| C、在流程③④⑤中溴元素均被氧化 |
| D、流程①中欲除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,操作步骤为:依次加入Na2CO3溶液、NaOH溶液、BaCl2溶液,然后过滤,最后加入盐酸 |
今有HA、H2B两种弱酸,有如下关系:H2B+A-=HB-+HA,B2-+HA=HB-+A-,则下列说法正确的是( )
| A、H2B的电离方程式为:H2B?2H++B2- |
| B、结合质子能力由强到弱的顺序为:B2->A->HB-C |
| C、等物质的量浓度NaA、NaHB、Na2B三种盐的水溶液,NaA碱性最强 |
| D、等pH的HA、H2B两种溶液中,水的电离出的氢离子前者大于后者 |
下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3 ②Al2O3③Al(OH)3 ④Al ⑤NaHSO4⑥AlCl3⑦NaAlO2.
①NaHCO3 ②Al2O3③Al(OH)3 ④Al ⑤NaHSO4⑥AlCl3⑦NaAlO2.
| A、①⑤ | B、②③④⑥⑦ |
| C、①②③④ | D、全部 |
 某学生设计一套实验装置如图所示,通过实验除去混在氮气中的氧气、二氧化碳、硫化氢和乙烯等气体,制得干燥的氮气.
某学生设计一套实验装置如图所示,通过实验除去混在氮气中的氧气、二氧化碳、硫化氢和乙烯等气体,制得干燥的氮气. 观察图a和图b,根据盖斯定律,写出△H1、△H2、△H3、△H4、△H5和△H6的关系.
观察图a和图b,根据盖斯定律,写出△H1、△H2、△H3、△H4、△H5和△H6的关系.