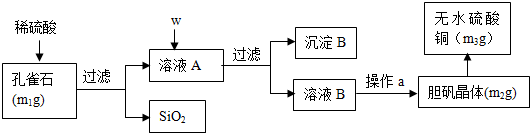
题目内容
13.下列各绸离子能在强酸性无色溶液中大量共存的是( )| A. | Na+、K+、HCO3-、Cl- | B. | K+、NH4+、Cl-、SO42- | ||
| C. | K+、Cu2+、SO42、Cl- | D. | Mg2+、Cu2+、Cl-、NO3- |
分析 溶液无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,强酸性溶液中存在大量氢离子,
A.碳酸氢根离子与氢离子反应;
B.四种离子之间不反应,都不与氢离子反应,且为无色溶液;
C.铜离子为有色离子,不满足溶液无色的条件;
D.铜离子为有色离子,不满足溶液无色的要求.
解答 解:无色溶液可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,强酸性溶液中存在大量氢离子,
A.HCO3-与氢离子反应,在溶液中不能大量共存,故A错误;
B.K+、NH4+、Cl-、SO42-之间不反应,都不与氢离子反应,且都是无色离子,在溶液中能够大量共存,故B正确;
C.Cu2+为有色离子,不满足溶液无色的要求,故C错误;
D.Cu2+为有色离子,不满足溶液无色的条件,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
4.a L含有硫酸铵和硝酸铵的混合溶液中,加入bmol NaOH并加热,恰好把NH3全部赶出;又加入cmol BaCl2沉淀反应恰好完全,则原溶液中NO3-的浓度为( )mol/L.
| A. | $\frac{b}{a}$ | B. | $\frac{c}{a}$ | C. | $\frac{b-2c}{a}$ | D. | $\frac{b-c}{a}$ |
1.将某元素的单质0.1mol与Cl2充分反应后,生成物的质量比原单质的质量增加了7.1g,这种元素肯定不是( )
| A. | Na | B. | Mg | C. | Cu | D. | Zn |
8.下列无法证明某酸HA是弱酸的实验方案是( )
| A. | 室温下,测得某HA溶液中c(HA)=0.01mol•L-1 | |
| B. | 碳酸钠溶液中滴入0.1mol•L-1的HA溶液,产生大量无色气体 | |
| C. | 室温下测得某HA溶液的pH=a,用蒸馏水稀释100倍测得溶液pH=b,且b-a<2 | |
| D. | 室温下,测得0.1mol•L-1HA溶液的pH>1,证明HA是弱酸 |
18.X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法不正确的是( )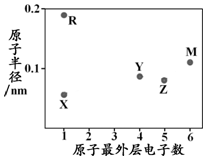

| A. | 简单阳离子半径:X<R | B. | 最高价含氧酸的酸性:Z<Y | ||
| C. | M的氢化物常温常压下为气体 | D. | X与Y可以形成正四面体结构的分子 |
5.(1)下列每组分别给出了两个量.其中可以组成一个物质的量公式的组有 (填编号)①④⑤
(2)在标准状况下:①6.72LCH4,②3.01×1023个HCl分子,③13.6gH2S,④0.2molNH3
下列对这四种气体的描述正确的是(填写代号)ABCD
A.质量②>③>①>④B.密度②>③>④>①C体积②>③>①>④D.氢原子数①>③>④>②
| ① | ② | ③ | ④ | ⑤ |
| 物质所含的微粒数 | 固体体积 | 溶液的质量百分比浓度 | 标准状况下气体的摩尔体积 | 非标准状况下某物质的质量 |
| 阿伏加德罗常数 | 固体密度 | 溶液体积 | 标准状况下气体的体积 | 物质的摩尔质量 |
下列对这四种气体的描述正确的是(填写代号)ABCD
A.质量②>③>①>④B.密度②>③>④>①C体积②>③>①>④D.氢原子数①>③>④>②
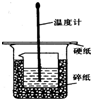 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题: 2NH3(g)△H=-92kJ/mol.
2NH3(g)△H=-92kJ/mol.