题目内容
1.将某元素的单质0.1mol与Cl2充分反应后,生成物的质量比原单质的质量增加了7.1g,这种元素肯定不是( )| A. | Na | B. | Mg | C. | Cu | D. | Zn |
分析 将某元素的单质0.1mol与Cl2充分反应后,生成物的质量比原单质的质量增加了7.1g,则增加的质量为氯气质量,n(Cl2)=$\frac{7.1g}{71g/mol}$=0.1mol,根据转移电子守恒判断元素.
解答 解:将某元素的单质0.1mol与Cl2充分反应后,生成物的质量比原单质的质量增加了7.1g,则增加的质量为氯气质量,n(Cl2)=$\frac{7.1g}{71g/mol}$=0.1mol,根据转移电子守恒知反应后该元素化合价=$\frac{0.1mol×2}{0.1mol}$-0=+2,
这几种元素只有Na反应后为+1价,故选A.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析计算能力,明确转移电子守恒是解本题关键,题目难度不大.

练习册系列答案
相关题目
9. 如图所示,E池中加入0.1mol/L CuCl2 溶液,F池中加入0.1mol/L AgNO3 溶液,将四个铂电极串联起来通电,则a,b,c,d 四电极上所产生的物质,其物质的量之比为( )
如图所示,E池中加入0.1mol/L CuCl2 溶液,F池中加入0.1mol/L AgNO3 溶液,将四个铂电极串联起来通电,则a,b,c,d 四电极上所产生的物质,其物质的量之比为( )
 如图所示,E池中加入0.1mol/L CuCl2 溶液,F池中加入0.1mol/L AgNO3 溶液,将四个铂电极串联起来通电,则a,b,c,d 四电极上所产生的物质,其物质的量之比为( )
如图所示,E池中加入0.1mol/L CuCl2 溶液,F池中加入0.1mol/L AgNO3 溶液,将四个铂电极串联起来通电,则a,b,c,d 四电极上所产生的物质,其物质的量之比为( )| A. | 2:2:4:1 | B. | 1:1:2:1 | C. | 2:1:l:1 | D. | 2:2:2:1 |
6.下列叙述正确的是( )
| A. | 虽然Cu能导电,但Cu是非电解质 | |
| B. | AgCl虽然难溶于水,但AgCl是电解质 | |
| C. | SO3、NH3的水溶液均能导电,所以SO3、NH3均是电解质 | |
| D. | KNO3溶液能导电,所以硝酸钾溶液是电解质 |
13.下列各绸离子能在强酸性无色溶液中大量共存的是( )
| A. | Na+、K+、HCO3-、Cl- | B. | K+、NH4+、Cl-、SO42- | ||
| C. | K+、Cu2+、SO42、Cl- | D. | Mg2+、Cu2+、Cl-、NO3- |
10.磷在氧气中燃烧,可能生成P2O3和P2O5,已知单质磷(P)的燃烧热为X kJ/mol,0.1molP在2.24L O2(标准状况下)燃烧至反应物耗尽时,放出Y kJ 的热量,则下列说法错误的是( )
| A. | 生成0.025 mol P2O5 | |
| B. | 生成 P2O3所释放的热量为(Y-0.05X) kJ | |
| C. | 2P(s)+$\frac{3}{2}$O2(g)=P2O3(s)△H=-(40Y-2X)kJ•mol-1 | |
| D. | 生成的 P2O3与 P2O5的质量之比为 1:1 |
 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应;通过测定反应过程中所放出的热量可计算中和反应热.
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应;通过测定反应过程中所放出的热量可计算中和反应热.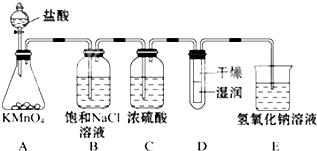 工业上将纯净干燥的氯气通入到0.5mol•L-1NaOH溶液中得到漂白水.某同学想在实验室探究Cl2性质并模拟制备漂白水,如图是部分实验装置.已知KMnO4与浓盐酸反应可以制取Cl2.(注:装置D中布条为红色)
工业上将纯净干燥的氯气通入到0.5mol•L-1NaOH溶液中得到漂白水.某同学想在实验室探究Cl2性质并模拟制备漂白水,如图是部分实验装置.已知KMnO4与浓盐酸反应可以制取Cl2.(注:装置D中布条为红色)