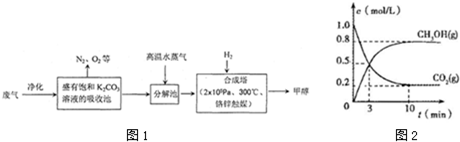
题目内容
20.孔雀石的主要成分为Cu2(OH)2CO3(含少量FeO、Fe2O3、SiO2).某小组同学在实验室以孔雀石为原料制备胆矾,并测定所得胆矾中结晶水的含量.实验步骤如下: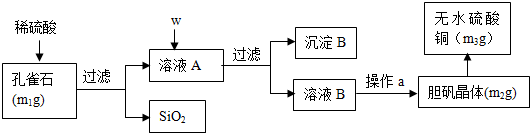
(提供试剂:NaOH溶液、H2O2溶液、CuO、Na2CO3)
完成下列填空:
(1)孔雀石的主要成分与稀硫酸反应的离子方程式为Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑.
(2)按试剂加入顺序,w所代表的试剂依次为H2O2溶液、CuO.沉淀B的成分为Fe(OH)3、CuO.
(3)a操作依次为:加热蒸发、冷却结晶、过滤、洗涤、自然干燥.除烧杯、漏斗之外过滤还需要另一玻璃仪器,该仪器在此操作中的主要作用是引流.
(4)欲检验溶液A中Fe2+的试剂是d(选填序号).如果测定Fe2+的含量,需要用容量瓶配制某标准溶液,请简述配置中“定容”的操作:
加水到离刻度线2~3cm处改用胶头滴管滴加蒸馏水,直到凹液面的最低线与刻度线相平.
a、NaOH(aq) b、Na2CO3(aq) c、淀粉KI(aq) d、酸性KMnO4(aq)
(5)在测定所得胆矾(CuSO4•xH2O)中结晶水x值的实验过程中,若测定结果的实验误差为1.5%,可能的原因是a、d.
a、加热温度过高 b、胆矾晶体的颗粒较大
c、加热后放在空气中冷却 d、加热胆矾晶体时有晶体从坩埚中溅出
(6)该小组一位同学根据实验结果求出样品中孔雀石的质量分数为:$\frac{{m}_{2}}{250}$×$\frac{222}{2{m}_{1}}$,另一位同学不同意,其原因是在除杂过程中加入了CuO,会使结果偏大.
分析 m1g孔雀石的主要成分为Cu2(OH)2CO3(含少量FeO、Fe2O3、SiO2),加入稀硫酸过滤得到滤渣二氧化硅和溶液A为硫酸铜、硫酸亚铁、硫酸铁,加入W为过氧化氢氧化亚铁离子为铁离子,加入氧化铜调节溶液的PH沉淀铁离子,过滤得到沉淀B为氢氧化铁和过量的氧化铜,溶液B为硫酸铜溶液,通过蒸发浓缩、冷却结晶、过滤洗涤、干燥得到硫酸铜晶体m2g,受热失去结晶水得到硫酸铜固体m3g,
(1)根据推导可知,E是二氧化碳,碱式碳酸铜和硫酸反应生成硫酸铜、水和二氧化碳;
(2)流程中分析可知,W为加入氧化剂氧化亚铁离子,加入氧化铜调节溶液PH使铁离子全部沉淀,过滤得到沉淀B为氢氧化铁和氧化铜;
(3)从溶液中获得硫酸铜晶体,直接加热会导致硫酸铜失去结晶水,应该采用加热浓缩、冷却结晶、过滤、自然干燥的操作方法;过滤中需要玻璃棒引流;
(4)Fe3+的检验方法为:取待测液于试管中,向待测溶液中加入KSCN溶液,溶液立刻变成红色说明溶液中有Fe3+,即Fe3++3SCN-?Fe(SCN)3;根据常见离子的颜色判断Fe3+(黄色);Fe3+与OH-反应生成红褐色Fe(OH)3;Fe2+的检验方法为:再取待测液于试管中,加KSCN溶液没有明显现象,加入氯水溶液变成红色,说明溶液只有Fe2+;根据常见离子的颜色判断Fe2+(浅绿色);向Fe2+溶液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色;Fe2+能使酸性KMnO4溶液褪色,注意混合溶液中亚铁离子检验需要注意现象的相互干扰,据此即可解答,A中含有铁离子和亚铁离子;
(5)应称量坩埚的质量,坩埚和晶体的质量,加热后坩埚的质量,加热后再称量一次坩埚的质量,判断质量是否发生变化,共称量4次;
a.加热温度过高,会导致硫酸铜分解,质量变化较大;
b.胆矾晶体的颗粒较大,会导致晶体解热分解不完全,质量变化偏小,结果偏小;
c.加热后放在空气中冷却,会吸收空气中的水重新形成晶体,结果偏小;
d.胆矾晶体溅出,导致结晶水含量增大;
(6)胆矾中的铜元素来自样品和调节pH时加入的氧化铜.
解答 解:(1)根据推导可知,E是二氧化碳,碱式碳酸铜和硫酸反应生成硫酸铜、水和二氧化碳,反应的离子方程式为:Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑,
故答案为:Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑;
(2)按试剂加入顺序,w所代表的试剂依次为加入氧化剂过氧化氢氧化亚铁离子,不引入其他杂志离子,加入氧化铜调节溶液PH使铁离子全部沉淀,过滤得到沉淀B为Fe(OH)3、CuO,
故答案为:H2O2溶液、CuO;Fe(OH)3、CuO;
(3)从溶液C中获得硫酸铜晶体,直接加热蒸干会导致硫酸铜失去结晶水,应该采用的操作方法为:加热浓缩、冷却结晶、过滤、自然干燥,除烧杯、漏斗之外过滤还需要另一玻璃仪器为玻璃棒,该仪器在此操作中的主要作用是引流,
故答案为:冷却结晶,自然干燥;引流;
(4)溶液A中含亚铁离子和铁离子,
a、NaOH溶液,向Fe2+溶液中加入NaOH溶液后,Fe2+与OH-反应生成Fe(OH)2,Fe2++2OH-=Fe(OH)2↓,Fe(OH)2不稳定易被氧气氧化为Fe(OH)3,4Fe(OH)2+O2+2H2O=4Fe(OH)3,白色的Fe(OH)2沉淀变成红褐色Fe(OH)3,向Fe2+溶液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色;Fe3+与OH-反应Fe3++3OH-=Fe(OH)3↓,生成红褐色Fe(OH)3,两者反应现象干扰,不能检验该溶液中存在Fe2+,故a错误;
b、Na2CO3(aq) 和亚铁离子生成沉淀,和铁离子双水解生成氢氧化铁沉淀和二氧化碳,溶液浑浊不能检验亚铁离子,故b错误;
c、淀粉KI(aq) 和铁离子发生氧化还原反应生成碘单质和亚铁离子,溶液颜色相近不能鉴别亚铁离子,故c错误;
d、酸性KMnO4(aq),因为Fe2+具有较强的还原性能使酸性KMnO4溶液褪色,Fe3+不能,故能够用酸性KMnO4溶液鉴别Fe2+和Fe3+,故d正确;
如果测定Fe2+的含量,需要用容量瓶配制某标准溶液,加水到离刻度线2~3cm处改用胶头滴管滴加蒸馏水,直到凹液面的最低线与刻度线相平,
故答案为:d;加水到离刻度线2~3cm处改用胶头滴管滴加蒸馏水,直到凹液面的最低线与刻度线相平;
(5)测定所得胆矾(CuSO4•xH2O)中结晶水x值,应称量坩埚的质量,坩埚和晶体的质量,加热后坩埚的质量,加热后再称量一次坩埚的质量,判断质量是否在误差允许范围内及两次值是否相差不超过0.1g,所以至少称量4次;
a.加热温度过高,会导致硫酸铜分解,质量变化较大,导致结果偏大,故a正确;
b.胆矾晶体的颗粒较大,会导致晶体解热分解不完全,质量变化偏小,结果偏小,故b错误;
c.加热后放在空气中冷却,会吸收空气中的水重新形成晶体,导致测定结果偏小,故c错误;
d.加热胆矾晶体时有晶体从坩埚中溅出,导致测定的结晶水的质量偏大,测定的x值偏大,故d正确;
故答案为:ad;
(6)向溶液中加入CuO调节溶液的pH,沉淀II为Fe(OH)3,所以胆矾中的铜元素不是都来自样品,因此该小组一位同学根据实验结果求出样品中CuO的质量分数偏大,
故答案为:在除杂过程中加入了CuO,会使结果偏大.
点评 本题考查了物质制备的过程分析判断,主要是杂质离子的分离、离子性质的理解应用、实验误差分析应用,明确流程为解题关键,题目难度中等.

| A. | Na+、K+、HCO3-、Cl- | B. | K+、NH4+、Cl-、SO42- | ||
| C. | K+、Cu2+、SO42、Cl- | D. | Mg2+、Cu2+、Cl-、NO3- |
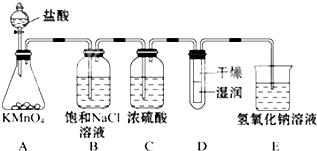 工业上将纯净干燥的氯气通入到0.5mol•L-1NaOH溶液中得到漂白水.某同学想在实验室探究Cl2性质并模拟制备漂白水,如图是部分实验装置.已知KMnO4与浓盐酸反应可以制取Cl2.(注:装置D中布条为红色)
工业上将纯净干燥的氯气通入到0.5mol•L-1NaOH溶液中得到漂白水.某同学想在实验室探究Cl2性质并模拟制备漂白水,如图是部分实验装置.已知KMnO4与浓盐酸反应可以制取Cl2.(注:装置D中布条为红色)
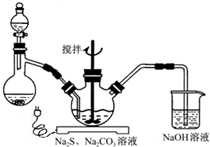 NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题:
NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题: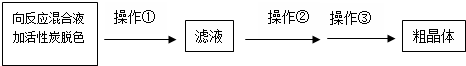
 苯乙酸是有机合成的中间产物,下面是它的一种实验室合成路线:
苯乙酸是有机合成的中间产物,下面是它的一种实验室合成路线: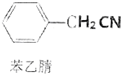 +H2O+H2SO4$\stackrel{100~130℃}{→}$
+H2O+H2SO4$\stackrel{100~130℃}{→}$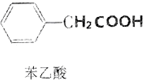 +NH4HSO4
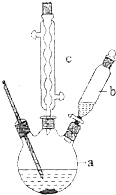
+NH4HSO4 图为实验室制溴苯的实验装置图,请根据图回答下列问题
图为实验室制溴苯的实验装置图,请根据图回答下列问题 .
.