题目内容
下列说法正确的是( )
| A、常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 | ||
| B、铁片镀锌时,铁片与外电源的正极相连 | ||
| C、NaClO溶液中通入少量CO2,ClO-水解程度增大,溶液碱性增强 | ||
D、t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,
|
考点:反应热和焓变,原电池和电解池的工作原理,化学平衡的影响因素,盐类水解的应用
专题:基本概念与基本理论
分析:A、△H-T△S<0时反应自发;
B、电镀时,镀件与作阴极,金属离子在其上发生还原反应;
C、二氧化碳与水反应生成碳酸,碳酸的酸性比次氯酸强;
D、通入氧气与NO反应,平衡正向移动,SO2转化率增大,
不变.
B、电镀时,镀件与作阴极,金属离子在其上发生还原反应;
C、二氧化碳与水反应生成碳酸,碳酸的酸性比次氯酸强;
D、通入氧气与NO反应,平衡正向移动,SO2转化率增大,
| c(NO)?c(SO3) |
| c(NO2)?c(SO2) |
解答:
解:A、△H-T△S<0时反应自发,该反应的△S<0,反应能自发进行,△H必须小于0,故A正确;
B、铁片镀锌时,铁片接电源负极,作阴极,锌离子在铁片上发生还原反应,故B错误;
C、二氧化碳与水反应生成碳酸,碳酸的酸性比次氯酸强,可以与NaClO反应生成HClO,故C错误;
D、通入氧气与NO反应,c(NO)减小,平衡正向移动,SO2转化率增大,
是化学平衡常数,不变,故D错误.
故选:A.
B、铁片镀锌时,铁片接电源负极,作阴极,锌离子在铁片上发生还原反应,故B错误;
C、二氧化碳与水反应生成碳酸,碳酸的酸性比次氯酸强,可以与NaClO反应生成HClO,故C错误;
D、通入氧气与NO反应,c(NO)减小,平衡正向移动,SO2转化率增大,
| c(NO)?c(SO3) |
| c(NO2)?c(SO2) |
故选:A.
点评:本题考查反应自发进行的条件、电镀、化学平衡常数及平衡移动等知识,题目难度不大.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
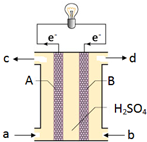 “长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分).某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,下列说法正确的是( )
“长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分).某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,下列说法正确的是( )| A、B为正极 |
| B、从a口通入四氧化二氮气体 |
| C、从d口排除的是NO气体 |
| D、A极发生的电极反应式:C2H8N2-16e-+8H2O=CO2+N2+16H+ |
现有如图甲、乙、丙、丁四种化学实验仪器或装置.下列操作中,符合实验要求的是( )


| A、用装置甲收集CH4,采取b端进气a端出气的方式 |
| B、用装置乙收集NO2气体 |
| C、用装置丙吸收NH3 |
| D、用仪器丁准确量取25.00mL酸性KMnO4溶液 |
下列说法正确的是( )
| A、在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度 |
B、如图,一段时间后给烧杯内地溶液中加入黄色的K3[Fe(CN)6]溶液,可看到Fe电极附近有蓝色沉淀生成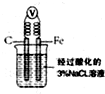 |
| C、用标准盐酸滴定待测NaOH溶液,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
| D、用加热的方式可提取NH4Cl固体中混有的少量的碘 |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、1mol?L-1 Na2CO3溶液中,含CO32-数目小于NA |
| B、标准状况下,11.2L O2和O3组成的混合气体含有原子数为NA |
| C、14 g聚乙烯与聚丙烯的混合物,含C-H键的数目为2NA |
| D、常温常压下,22.4L CO2与足量Na2O2反应转移电子数为NA |
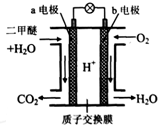 二甲醚是一种绿色、可再生的新能源.如图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )
二甲醚是一种绿色、可再生的新能源.如图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )| A、a电极为该电池负极 |
| B、当有0.4mol电子转移时,b极消耗O2 2.24L |
| C、电池工作时,a电极反应式:CH3OCH3-12e-+3H2O→2CO2↑+12H+ |
| D、电池工作时,燃料电池内部H+从a电极移向b电极 |
化学与社会、生产、生活紧切相关.下列说法正确的是( )
| A、石英只能用于生产光导纤维 |
| B、从海水提取物质都必须通过化学反应才能实现 |
| C、为了增加食物的营养成分,可以大量使用食品添加剂 |
| D、淀粉、纤维素和脂肪在一定条件下都可以发生水解反应 |
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、Na2O和Na2O2的混合物共1mol,阴离子数目为NA |
| B、过量的Fe与Cl2反应生成0.1mol产物时失去的电子数为0.2NA |
| C、标准状况下,11.2 L CHCl3中含有C-Cl键的数目为1.5NA |
| D、一定条件下,2mol H2和0.5mol N2充分反应后可得到NH3分子数为NA |
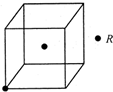 现有X、Y、Z、W、R五种元素,其中前四种为短周期主族元素.X原子的最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价的代数和为6;X、Z同主族,W与X、Y均不同周期,R2+的价电子排布式为3d5.
现有X、Y、Z、W、R五种元素,其中前四种为短周期主族元素.X原子的最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价的代数和为6;X、Z同主族,W与X、Y均不同周期,R2+的价电子排布式为3d5.