题目内容
实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+Hg═Cu2HgI4+2Cu.下列说法中正确的是( )
| A、该反应的氧化剂为CuI,氧化产物为Cu |
| B、产物Cu2HgI4中,Cu元素的化合价为+2 |
| C、当有2mol CuI参与反应时,转移电子为1mol |
| D、由Cu2+与I直接反应制得CuI的离子方程式为Cu2++I-=CuI |
考点:氧化还原反应
专题:氧化还原反应专题
分析:反应4CuI+Hg═Cu2HgI4+2Cu中,Cu元素化合价部分由+1价降低到0价,被还原,CuI为氧化剂,Hg元素化合价由0价升高到+2价,Hg为还原剂,结合元素化合价的变化解答该题.
解答:
解:A.Cu元素化合价部分由+1价降低到0价,CuI为氧化剂,被还原,所以Cu为还原产物,故A错误;
B.Cu2HgI4中Cu元素的化合价为+1价,Hg为+2价,I为-1价,故B错误;
C.由方程式可知,当有4molCuI参加反应时,转移2mol电子,则有2mol CuI参与反应时,转移电子为1mol,故C正确;
D.Cu2+与I-直接反应制得CuI的反应中,得电子,Cu化合价由+2价降为+1价;失电子,I化合价由-1价升高为0价,根据氧化还原反应氧化剂和还原剂得失电子数目相等,则有2molCu2+参加反应生成1molI3-,则反应的离子方程式为2Cu2++5I-=2CuI+I3-,故D错误.
故选C.
B.Cu2HgI4中Cu元素的化合价为+1价,Hg为+2价,I为-1价,故B错误;
C.由方程式可知,当有4molCuI参加反应时,转移2mol电子,则有2mol CuI参与反应时,转移电子为1mol,故C正确;
D.Cu2+与I-直接反应制得CuI的反应中,得电子,Cu化合价由+2价降为+1价;失电子,I化合价由-1价升高为0价,根据氧化还原反应氧化剂和还原剂得失电子数目相等,则有2molCu2+参加反应生成1molI3-,则反应的离子方程式为2Cu2++5I-=2CuI+I3-,故D错误.
故选C.
点评:本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意从元素化合价的角度认识相关概念并把握物质的性质,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、1mol?L-1 Na2CO3溶液中,含CO32-数目小于NA |
| B、标准状况下,11.2L O2和O3组成的混合气体含有原子数为NA |
| C、14 g聚乙烯与聚丙烯的混合物,含C-H键的数目为2NA |
| D、常温常压下,22.4L CO2与足量Na2O2反应转移电子数为NA |
 25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol?L-1.如图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线.下列说法中,正确的是( )
25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol?L-1.如图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线.下列说法中,正确的是( )| A、加NaOH,HA电离平衡常数增大 |
| B、通入HCl,溶液中阴离子浓度之和减小 |
| C、溶液中水的电离程度a>b>c |
| D、b点溶液中,c(HA)<c(A-) |
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、Na2O和Na2O2的混合物共1mol,阴离子数目为NA |
| B、过量的Fe与Cl2反应生成0.1mol产物时失去的电子数为0.2NA |
| C、标准状况下,11.2 L CHCl3中含有C-Cl键的数目为1.5NA |
| D、一定条件下,2mol H2和0.5mol N2充分反应后可得到NH3分子数为NA |
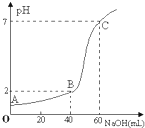 常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示.下列叙述正确的是( )
常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示.下列叙述正确的是( )| A、所用HCl的浓度是0.09mol?L-1,NaOH溶液浓度为0.03mol?L-1 |
| B、在B点,溶液中离子浓度关系为:c(Cl-)>c(Na+)>c(H+)>c(OH-) |
| C、A.B.C三点水的电离程度大小依次为:A>B>C |
| D、滴定前,锥形瓶用待测液润洗,导致HCl浓度偏低 |
下列反应的离子方程式正确的是( )
| A、过量氯气通入溴化亚铁溶液中:2Cl2+2Fe2++2Br-═4Cl-+2Fe3++Br2 |
B、向苯酚溶液中滴加Na2CO3溶液: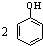 +CO32-→ +CO32-→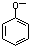 +CO2↑+H2O +CO2↑+H2O |
| C、足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O═2HCO3- |
| D、用过量的冷氨水吸收SO2:SO2+2NH3?H2O═SO32-+2NH4++H2O |
 A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:
A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表: 已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.
已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.