题目内容
 已知某温度下,在2L密闭容器中加入一定量A,发生以下化学反应:
已知某温度下,在2L密闭容器中加入一定量A,发生以下化学反应:2A(g)?B(g)+C(g);△H=-48.25kJ/L时间t与A、B的浓度有如图所示关系,若测得第15min时c(B)=1.6mol/L,则下列结论正确的是( )
| A、该温度下此反应平衡常数为3.2 | ||
| B、A的初始物质的量为4 mol | ||
| C、0-15min内,气体密度不变 | ||
D、要使
|
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:由图可知,15min时反应到达平衡,平衡时c(B)=1.6mol?L-1,
=2,故平衡时c(A)=0.8mol/L;
A.根据浓度变化量之比等于化学计量数之比计算平衡时c(C),代入平衡常数表达式k=
计算;
B.根据浓度变化量之比等于化学计量数之比计算△c(A),A的平衡浓度+△c(A)=A的起始浓度,再根据n=cV计算;
C.反应过程中气体质量不变,体积不变,密度不变;
D.要使
=3,应改变条件使c(B)增大,c(A)降低,结合外界条件对平衡影响分析.
| c(B) |
| c(A) |
A.根据浓度变化量之比等于化学计量数之比计算平衡时c(C),代入平衡常数表达式k=
| c(B)c(C) |
| c2(A) |
B.根据浓度变化量之比等于化学计量数之比计算△c(A),A的平衡浓度+△c(A)=A的起始浓度,再根据n=cV计算;
C.反应过程中气体质量不变,体积不变,密度不变;
D.要使
| c(B) |
| c(A) |
解答:
解:由图可知,15min时反应到达平衡,平衡时c(B)=1.6mol?L-1,
=2,故平衡时c(A)=0.8mol/L;
A.浓度变化量之比等于化学计量数之比,故平衡时c(C)=c(B)=1.6mol?L-1,故平衡常数表达式k=
=
=0.04,故A错误;
B.浓度变化量之比等于化学计量数之比,故△c(A)=2c(B)=2×1.6mol?L-1=3.2mol?L-1,A的起始浓度为3.2mol?L-1+0.8mol/L=4mol/L,故A的初始物质的量为4mol/L×2L=8 mol,故B错误;
C.在2L密闭容器中反应过程中气体质量不变,体积不变,密度不变,故C正确;
D.要使
=3,应改变条件使c(B)增大,c(A)降低,可以只增大B的浓度,该反应为放热反应,可以降低温度使平衡向正反应进行,故D错误;
故选C.
| c(B) |
| c(A) |
A.浓度变化量之比等于化学计量数之比,故平衡时c(C)=c(B)=1.6mol?L-1,故平衡常数表达式k=
| c(B)c(C) |
| c2(A) |
| 1.6×1.6 |
| 0.82 |
B.浓度变化量之比等于化学计量数之比,故△c(A)=2c(B)=2×1.6mol?L-1=3.2mol?L-1,A的起始浓度为3.2mol?L-1+0.8mol/L=4mol/L,故A的初始物质的量为4mol/L×2L=8 mol,故B错误;
C.在2L密闭容器中反应过程中气体质量不变,体积不变,密度不变,故C正确;
D.要使
| c(B) |
| c(A) |
故选C.
点评:本题考查化学平衡图象、有关计算、影响平衡的因素等,注意D选项,反应前后气体的体积不变,只降低A的浓度所到达的平衡状态与原平衡状态为等效平衡,c(B)/c(A)值不变,题目难度中等.

练习册系列答案
相关题目
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、Na2O和Na2O2的混合物共1mol,阴离子数目为NA |
| B、过量的Fe与Cl2反应生成0.1mol产物时失去的电子数为0.2NA |
| C、标准状况下,11.2 L CHCl3中含有C-Cl键的数目为1.5NA |
| D、一定条件下,2mol H2和0.5mol N2充分反应后可得到NH3分子数为NA |
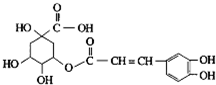 金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )
金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )| A、绿原酸的分子式为C16H8O9 |
| B、1mol绿原酸最多与4mol NaOH反应 |
| C、1个绿原酸分子中含有4个手性碳原子 |
| D、绿原酸分子中有4种化学环境不同的氢原子 |
下列说法中,不正确的是( )
| A、恒容密闭容器中进行反应:2A2(g)+B2(g)?2A2B(g);△H<0,达到化学平衡后,加热会使逆反应速率大于正反应速率 |
| B、在常温下,用惰性电极电解饱和Na2CO3溶液,Na2CO3溶液的浓度不变 |
| C、使用催化剂能够改变反应历程,增大反应物分子的接触面积,从而加快反应速率 |
| D、放热或熵增过程自发进行的可能性比吸热或熵减过程要大 |
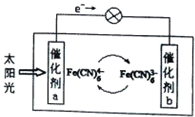 一种太阳能电池的工作原理示意图如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
一种太阳能电池的工作原理示意图如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )| A、K+移向催化剂b |
| B、催化剂a表面发生反应:Fe(CN)64--e-═Fe(CN)63- |
| C、Fe(CN)63-在催化剂b表面被氧化 |
| D、电解质溶液中Fe(CN)63-和Fe(CN)64-浓度基本保持不变 |
十八大报告中提出“大力推进生态文明建设,提高生态文明水平,建设美丽中国”.化学已渗透到人类生活的各个方面.下列说法正确的是( )
| A、PM2.5是指大气中直径≤2.5微米的颗粒物,只要戴普通口罩就对人体健康无影响 |
| B、乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的 |
| C、绚丽缤纷的烟花中可能添加了含钾、钠、钙、铜等某些金属元素的化合物 |
| D、制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
下列说法正确的是( )
| A、蛋白质及其水解产物都具有两性 |
| B、淀粉和油脂都是可水解的高分子化合物 |
| C、鸡蛋清溶液中加入饱和Na2SO4溶液有沉淀生成是因为蛋白质变性 |
| D、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |