题目内容
元素周期表中短周期元素W、X、Y、Z,原子序数依次增大,液态的单质W是火箭起飞的重要燃料;X原子的最外层电子数是内层电子数的3倍;元素Y在自然界中只能以化合态存在,而且元素Y在组成海水盐类物质的所有元素中,质量分数为第二;Z原子在同周期中原子半径最小(除稀有气体外).下列说法错误的是( )
| A、元素W与元素X形成的含有共价键的化合物只有一种 |
| B、元素X的单质与元素Y的单质反应时,反应条件不同,产物也不同 |
| C、元素Y与元素W可以原子个数比为1:1的化合物甲,且甲与水反应有气体产生 |
| D、元素Z的单质与元素W.Y的单质都能反应,且反应中Z的单质都做氧化剂 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:元素周期表中短周期元素W、X、Y、Z,原子序数依次增大,液态的单质W是火箭起飞的重要燃料,应为氢气,则W为H,X原子的最外层电子数是内层电子数的3倍,应为O;元素Y在自然界中只能以化合态存在,而且元素Y在组成海水盐类物质的所有元素中,质量分数为第二,应为Na;Z原子在同周期中原子半径最小,应为Cl元素,结合元素对应的单质、化合物的性质解答该题.
解答:
解:元素周期表中短周期元素W、X、Y、Z,原子序数依次增大,液态的单质W是火箭起飞的重要燃料,应为氢气,则W为H,X原子的最外层电子数是内层电子数的3倍,应为O;元素Y在自然界中只能以化合态存在,而且元素Y在组成海水盐类物质的所有元素中,质量分数为第二,应为Na;Z原子在同周期中原子半径最小,应为Cl元素,
A.H、O可形成H2O和H2O2,且其中都含共价键,故A错误;
B.常温时,Na与氧气反应生成Na2O,而加热条件下Na与氧气反应生成Na2O2,故B正确;
C.化合物甲为NaH,该物质与水反应生成氢气,故C正确;
D.氯气与氢气反应,氯气与钠反应,都是氯气做氧化剂,故D正确.
故选A.
A.H、O可形成H2O和H2O2,且其中都含共价键,故A错误;
B.常温时,Na与氧气反应生成Na2O,而加热条件下Na与氧气反应生成Na2O2,故B正确;
C.化合物甲为NaH,该物质与水反应生成氢气,故C正确;
D.氯气与氢气反应,氯气与钠反应,都是氯气做氧化剂,故D正确.
故选A.
点评:本题考查结构性质与位置关系、元素周期律等,侧重于学生的分析能力的考查,难度不大,根据推断元素是解题的关键,注意相关基础知识的积累.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
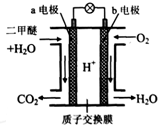 二甲醚是一种绿色、可再生的新能源.如图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )
二甲醚是一种绿色、可再生的新能源.如图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )| A、a电极为该电池负极 |
| B、当有0.4mol电子转移时,b极消耗O2 2.24L |
| C、电池工作时,a电极反应式:CH3OCH3-12e-+3H2O→2CO2↑+12H+ |
| D、电池工作时,燃料电池内部H+从a电极移向b电极 |
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、Na2O和Na2O2的混合物共1mol,阴离子数目为NA |
| B、过量的Fe与Cl2反应生成0.1mol产物时失去的电子数为0.2NA |
| C、标准状况下,11.2 L CHCl3中含有C-Cl键的数目为1.5NA |
| D、一定条件下,2mol H2和0.5mol N2充分反应后可得到NH3分子数为NA |
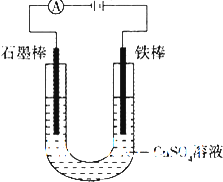 如图装置,U形管中装有50mL 2mol?L-1的CuSO4溶液.通电一段时间后,下列说法正确的是( )
如图装置,U形管中装有50mL 2mol?L-1的CuSO4溶液.通电一段时间后,下列说法正确的是( )| A、转移0.2 mol电子时,阳极减少质量大于阴极增加质量 |
| B、转移0.4 mol电子时,阴极得到2.24 L标准状况下的气体 |
| C、电解一段时间后,U形管中会产生红褐色物质,后来逐渐溶解 |
| D、若将石墨棒换成铜棒,可实现铁制品上镀铜 |
下列化学用语不能正确解释相关事实的是( )
| A、碱性氢氧燃料电池的正极反应:H2-2e-+2OH-═2H2O | ||||
B、用电子式表示NaCl的形成过程: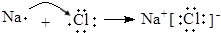 | ||||
| C、向含有Hg2+的废水中加入Na2S可除去Hg2+:Hg2++S2-═HgS↓ | ||||
D、汽车尾气系统的催化转化器可降低NO等的排放:2CO+2NO
|
下列溶液中,各组离子能大量共存的是( )
| A、pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
| B、在强酸溶液中:Na+、ClO-、Cl-、Ba2+ |
| C、在含有大量Fe3+的溶液中:NH4+、Cl-、Na+、SCN- |
| D、由水电离的c(H+)=10-13mol?L-1的溶液中:Na+、Cl-、K+、SO42- |
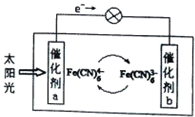 一种太阳能电池的工作原理示意图如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
一种太阳能电池的工作原理示意图如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )| A、K+移向催化剂b |
| B、催化剂a表面发生反应:Fe(CN)64--e-═Fe(CN)63- |
| C、Fe(CN)63-在催化剂b表面被氧化 |
| D、电解质溶液中Fe(CN)63-和Fe(CN)64-浓度基本保持不变 |