题目内容
 通过海水能获得淡水、食盐、镁等,食盐可进一步用于氯碱工业.请回答下列问题.
通过海水能获得淡水、食盐、镁等,食盐可进一步用于氯碱工业.请回答下列问题.(1)列举两种海水淡化的方法:
(2)氯碱工业通过电解饱和食盐水能获得烧碱和氯气等物质,该反应的化学方程式为
(3)侯氏制碱法中,首先向饱和食盐水中通入CO2和NH3制备NaHCO3,其化学方程式为
(4)目前世界上60%以上的镁都是从海水中提取的,已知:MgO和MgCl2的熔点分别为2852℃和714℃.分析说明工业上采用电解熔融MgCl2而不是电解熔融Mg0的理由
考点:海水资源及其综合利用,原电池和电解池的工作原理
专题:电化学专题
分析:(1)淡化海水,应降低水中的离子浓度,可用蒸馏法、离子交换法、电渗析法等;
(2)电解饱和食盐水,阳极生成氯气,阴极生成氢气,图中铁应为阴极,应用阳离子交换膜;
(3)氨气易溶于水,而二氧化碳微溶,应先通入氨气;
(4)氧化镁和氯化镁在熔融状态下都能导电,电解时应考虑节约能源.
(2)电解饱和食盐水,阳极生成氯气,阴极生成氢气,图中铁应为阴极,应用阳离子交换膜;
(3)氨气易溶于水,而二氧化碳微溶,应先通入氨气;
(4)氧化镁和氯化镁在熔融状态下都能导电,电解时应考虑节约能源.
解答:
解:(1)常见淡化海水的方法有蒸馏法、离子交换法、电渗析法等,故答案为:蒸馏法;离子交换法;
(2)工业电解饱和食盐水,生成氢氧化钠、氢气和氯气,电解方程式为2NaCl+2H2O
2NaOH+H2↑+Cl2↑,电解饱和食盐水时,如用铁为电解,铁应连接电源负极,否则铁被氧化,则石墨为阳极,连接电源正极,电解池工作时,阴极发生还原反应,电极方程式为2H++2e-═H2↑,由离子的移动方向可知图中交换膜为阳离子交换膜,可通过的离子为Na+和H+,
故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;正;2H++2e-═H2↑;Na+和H+;
(3)氨气极易溶于水,而二氧化碳微溶于水,先通入氨气,溶液呈碱性,再通入二氧化碳气体可之更多地转化为HCO3-,反应的方程式为NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl,
故答案为:NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl;NH3;NH3极易溶于NaCl溶液,而CO2在NaCl溶液中溶解度很小;
(4)MgO比MgCl2熔点高,电解MgO比电解MgCl2的电能多,浪费资源,
故答案为:由于熔点MgO>MgCl2,电解MgO耗费电多,而电解MgCl2耗电较少.
(2)工业电解饱和食盐水,生成氢氧化钠、氢气和氯气,电解方程式为2NaCl+2H2O
| ||
故答案为:2NaCl+2H2O
| ||
(3)氨气极易溶于水,而二氧化碳微溶于水,先通入氨气,溶液呈碱性,再通入二氧化碳气体可之更多地转化为HCO3-,反应的方程式为NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl,
故答案为:NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl;NH3;NH3极易溶于NaCl溶液,而CO2在NaCl溶液中溶解度很小;
(4)MgO比MgCl2熔点高,电解MgO比电解MgCl2的电能多,浪费资源,
故答案为:由于熔点MgO>MgCl2,电解MgO耗费电多,而电解MgCl2耗电较少.
点评:本题考查较为综合,涉及食盐的工业应用,注意把握工业制备原理和操作方法,结合物质的性质解答该题,牢固把握相关基础知识是解答该类题目的关键,题目难度不大.

练习册系列答案
相关题目
现有如图甲、乙、丙、丁四种化学实验仪器或装置.下列操作中,符合实验要求的是( )


| A、用装置甲收集CH4,采取b端进气a端出气的方式 |
| B、用装置乙收集NO2气体 |
| C、用装置丙吸收NH3 |
| D、用仪器丁准确量取25.00mL酸性KMnO4溶液 |
化学与社会、生产、生活紧切相关.下列说法正确的是( )
| A、石英只能用于生产光导纤维 |
| B、从海水提取物质都必须通过化学反应才能实现 |
| C、为了增加食物的营养成分,可以大量使用食品添加剂 |
| D、淀粉、纤维素和脂肪在一定条件下都可以发生水解反应 |
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、Na2O和Na2O2的混合物共1mol,阴离子数目为NA |
| B、过量的Fe与Cl2反应生成0.1mol产物时失去的电子数为0.2NA |
| C、标准状况下,11.2 L CHCl3中含有C-Cl键的数目为1.5NA |
| D、一定条件下,2mol H2和0.5mol N2充分反应后可得到NH3分子数为NA |
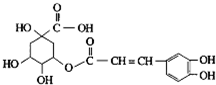 金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )
金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )| A、绿原酸的分子式为C16H8O9 |
| B、1mol绿原酸最多与4mol NaOH反应 |
| C、1个绿原酸分子中含有4个手性碳原子 |
| D、绿原酸分子中有4种化学环境不同的氢原子 |
 现有X、Y、Z、W、R五种元素,其中前四种为短周期主族元素.X原子的最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价的代数和为6;X、Z同主族,W与X、Y均不同周期,R2+的价电子排布式为3d5.
现有X、Y、Z、W、R五种元素,其中前四种为短周期主族元素.X原子的最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价的代数和为6;X、Z同主族,W与X、Y均不同周期,R2+的价电子排布式为3d5.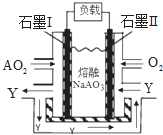 A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:
A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表: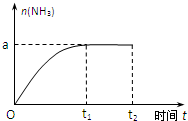 已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.
已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.