题目内容
13.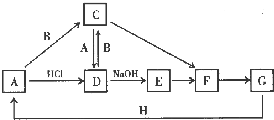 A~H 是中学化学中常见的物质,转化关系如下图所示(部分反应物、反应条件和产物已略去).A、H 是常见的金属单质,工业上常用电解法冶炼H;通常状况下B 为黄绿色气体;G 为红棕色固体;C、D、E、F、G 物种化合物含有同一种元素.
A~H 是中学化学中常见的物质,转化关系如下图所示(部分反应物、反应条件和产物已略去).A、H 是常见的金属单质,工业上常用电解法冶炼H;通常状况下B 为黄绿色气体;G 为红棕色固体;C、D、E、F、G 物种化合物含有同一种元素.(1)B 的电子式为
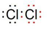 .
.(2)检验D 中金属阳离子的实验方案是(或取少量D溶液于试管中,滴加K3[Fe(CN)6]溶液,若出现蓝色沉淀,则D溶液中含Fe2+)先滴加KSCN溶液再滴加氯水,若滴加KSCN溶液时未出现明显现象,滴加氯水后出现血红色,则D溶液中含Fe2+(或取少量D溶液于试管中,滴加K3[Fe(CN)6]溶液,若出现蓝色沉淀,则D溶液中含Fe2+).
(3)金属H 既能与强酸反应又能与强碱反应,其与NaOH 溶液反应的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑.
(4)E 在空气中转化成F 的化学方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3.
(5)理论上G 与H 反应生成1mol 固体A 放出428kJ 热量,G 与H 反应的热化学方程式为2Al(s)+Fe2O3(s)═2Fe(s)+Al2O3(s)△H=-856kJ•mol-1.
(6)单质A 在氧气中的燃烧产物X 可用于去除地下水中的TcO4-(99Tc具有放射性).在酸性条件下,X 将TcO4--转化为难溶于水的 TcO2,同时得到F,该反应的离子方程式为3Fe3O4+TcO4-+H++13H2O═9Fe(OH)3+TcO2.
分析 通常状况下B 为黄绿色气体,则B为Cl2,A是常见的金属单质,且A与盐酸反应生成D,D又与氯气反应生成C,A也能与氯气反应生成C,且A与C反应生成D,则A应为Fe,D为FeCl2,C为FeCl3,C、D、E、F、G 物种化合物含有同一种元素,且G 为红棕色固体,D与氢氧化钠反应生成E为Fe(OH)2,E氧化得F为Fe(OH)3,F受执分解得G为Fe2O3,H 是常见的金属单质,工业上常用电解法冶炼H,金属H 既能与强酸反应又能与强碱反应,则H应为Al,氧化铁与铝发生铝热反应得铁,符合各物质的转化关系,据此答题;
解答 解:通常状况下B 为黄绿色气体,则B为Cl2,A是常见的金属单质,且A与盐酸反应生成D,D又与氯气反应生成C,A也能与氯气反应生成C,且A与C反应生成D,则A应为Fe,D为FeCl2,C为FeCl3,C、D、E、F、G 物种化合物含有同一种元素,且G 为红棕色固体,D与氢氧化钠反应生成E为Fe(OH)2,E氧化得F为Fe(OH)3,F受执分解得G为Fe2O3,H 是常见的金属单质,工业上常用电解法冶炼H,金属H 既能与强酸反应又能与强碱反应,则H应为Al,氧化铁与铝发生铝热反应得铁,符合各物质的转化关系,
(1)根据上面的分析可知,B为Cl2,B 的电子式为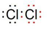 ,
,
故答案为: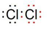 ;
;
(2)D为FeCl2,检验D 中金属阳离子的实验方案是 先滴加KSCN溶液再滴加氯水,若滴加KSCN溶液时未出现明显现象,滴加氯水后出现血红色,则D溶液中含Fe2+
(或取少量D溶液于试管中,滴加K3[Fe(CN)6]溶液,若出现蓝色沉淀,则D溶液中含Fe2+),
故答案为:先滴加KSCN溶液再滴加氯水,若滴加KSCN溶液时未出现明显现象,滴加氯水后出现血红色,则D溶液中含Fe2+(或取少量D溶液于试管中,滴加K3[Fe(CN)6]溶液,若出现蓝色沉淀,则D溶液中含Fe2+);
(3)金属H 既能与强酸反应又能与强碱反应,其与NaOH 溶液反应的离子方程式为 2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(4)E为Fe(OH)2,E 在空气中转化成F 的化学方程式为 4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(5)G为Fe2O3,理论上G 与H 反应生成1mol 固体Fe 放出428kJ 热量,则生成2mol铁应放出856kJ 热量,G 与H 反应的热化学方程式为2Al(s)+Fe2O3(s)═2Fe(s)+Al2O3(s)△H=-856kJ•mol-1,
故答案为:2Al(s)+Fe2O3(s)═2Fe(s)+Al2O3(s)△H=-856 kJ•mol-1;
(6)单质铁在氧气中的燃烧产物X应为Fe3O4,在酸性条件下,Fe3O4 将TcO4--转化为难溶于水的 TcO2,同时得到Fe(OH)3,该反应的离子方程式为 3Fe3O4+TcO4-+H++13H2O═9Fe(OH)3+TcO2,
故答案为:3Fe3O4+TcO4-+H++13H2O═9Fe(OH)3+TcO2.
点评 本题考查了物质转化关系的判断,物质性质的应用,反应现象的应用,主要考查铁及其化合物性质,综合性较强,对学生的综合分析问题的能力要求较高,题目难度中等.

 名校课堂系列答案
名校课堂系列答案①CaO+2NH4Cl=CaCl2+2NH3↑+H2O
②2Na+2NH3=2NaNH2+H2↑
③3Mg(NH2)2=Mg3N2+4NH3↑
④NH4Cl+NaNH2=NaCl+2NH3↑
| A. | 只有③ | B. | 只有① | C. | ①和② | D. | 都正确 |
| 阳离子 | K+Na+Cu2+Al3+ |
| 阴离子 | SO42- HCO3-NO3-OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体,只有C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.根据上述实验填空:
(1)写出B、C的化学式:BKNO3,CKAl(SO4)2.
(2)将含l mol A的溶液与含l mol E的溶液反应后蒸干,仅得到一种化合物,该化合物化学式为Na2CO3.
(3)C常用作净水剂,用离子方程式表示其净水原理Al3++3H2O?Al(OH)3+3H+.
(4)在A溶液中加入过量澄清石灰水,其离子方程式为2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+H2O.
(5)向20mL 2mol/L C溶液中加入60mL E溶液,充分反应后得到0.78g沉淀,则E溶液的物质的量浓度可能是0.5和2.5moI/L.
| A. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| B. | 绿色化学的核心是利用化学原理治理环境污染 | |
| C. | 将煤气化或液化,获得清洁燃料 | |
| D. | 向高空排放金属冶炼产生的粉尘 |
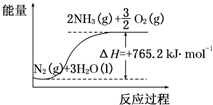 一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2,进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2,进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
(1)50℃时从开始到3h内以O2物质的量变化表示的平均反应速率为1.5×10-6 mol•h-1.
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是N2(g)+3H2O(l)=2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.2kJ•mol-1.
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢.请提出可提高其反应速率且增大NH3生成量的建议:升高温度.
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10L.求:
①该条件下的平衡常数为400;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.反应放出的热量<(填“>”“<”或“=”)92.4kJ.
| A. | 、加入氯化铁的目的是加深溶液颜色,放大实验现象 | |
| B. | 、本实验的目的是研究浓度对双氧水分解速率的影响 | |
| C. | 、本实验过程中A、B试管都不明显,可以将那个很不明显的试管放入热水浴中来观察 | |
| D. | 、小明刚把A药品准备好,就有事情出去了,第二天继续这个实验来进行比较 |
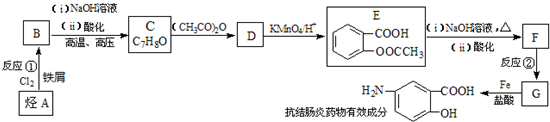
 $→_{盐酸}^{Fe}$
$→_{盐酸}^{Fe}$ (苯胺易被氧化)
(苯胺易被氧化) .
.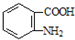 )合成路线中两种中间产物的结构简式(部分反应条件已略去)
)合成路线中两种中间产物的结构简式(部分反应条件已略去)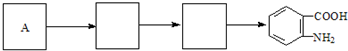
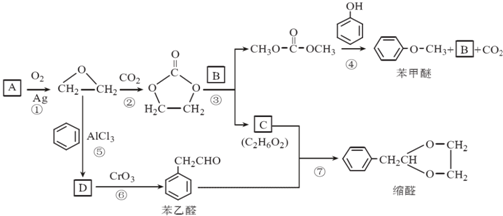
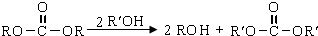
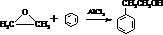 .
.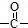 结构的苯乙醛的所有同分异构体的结构简式:
结构的苯乙醛的所有同分异构体的结构简式: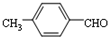 、
、 .
.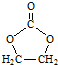 的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备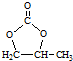 的合成路线(注明必要的反应条件)
的合成路线(注明必要的反应条件)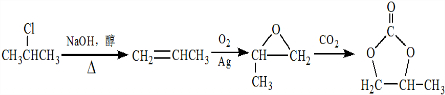 .
.