题目内容
18. 一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2,进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2,进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
(1)50℃时从开始到3h内以O2物质的量变化表示的平均反应速率为1.5×10-6 mol•h-1.
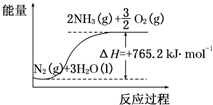
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是N2(g)+3H2O(l)=2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.2kJ•mol-1.
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢.请提出可提高其反应速率且增大NH3生成量的建议:升高温度.
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10L.求:
①该条件下的平衡常数为400;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.反应放出的热量<(填“>”“<”或“=”)92.4kJ.
分析 (1)结合v=$\frac{△c}{△t}$计算;
(2)由图可知反应物、生成物及能量变化;
(3)由数据可知,温度越高,生成氨气的量越大;
(4)①某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10L,则
N2(g)+3H2(g)?2NH3(g)
开始 2 4 0
转化 1 3 2
平衡 1 1 2
结合平衡浓度计算K;
②极限转化为反应物时,为2mol N2和4mol H2,平衡时各组分的物质的量与上述平衡相同,从正逆反应开始,该反应伴随吸热.
解答 解:(1)50℃时从开始到3h内生成氨气为6×10-6mol,则生成氧气为4.5×10-6mol,以O2物质的量变化表示的平均反应速率为$\frac{4.5×1{0}^{-6}}{3}$mol•h-1=1.5×10-6mol•h-1,
故答案为:1.5×10-6;
(2)由图可知反应物、生成物及能量变化,反应的热化学方程式是N2(g)+3H2O(l)=2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.2kJ•mol-1,
故答案为:N2(g)+3H2O(l)=2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.2kJ•mol-1;
(3)由数据可知,温度越高,生成氨气的量越大,则可提高其反应速率且增大NH3生成量的建议为升高温度,故答案为:升高温度;
(4)①某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10L,则
N2(g)+3H2(g)?2NH3(g)
开始 2 4 0
转化 1 3 2
平衡 1 1 2
K=$\frac{(\frac{2}{10})^{2}}{(\frac{1}{10})×(\frac{1}{10})^{3}}$=400,
故答案为:400;
②当加入2mol N2和4mol H2时,生成2mol NH3,放出92.4kJ的热量,而当加入a mol N2、b mol H2和c mol NH3时,平衡时NH3仍为2mol,则生成的NH3为(2-c) mol,则放出的热量小于92.4kJ,故答案为:<.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、平衡常数及速率计算为解答的关键,侧重分析与计算能力的考查,注意图象及表格数据的应用,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 聚乙烯塑料的老化是由于发生了加成反应 | |
| B. | 乙酸乙酯在碱性条件下的水解反应称为皂化反应 | |
| C. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 | |
| D. | 棉、麻、合成纤维完全燃烧都只生成CO2和H2O |
| A. | Na2O2可作漂白剂和供氧剂,碳酸钠可用于治疗胃酸过多 | |
| B. | 工业上用次氯酸制漂白粉,保存漂白粉的塑料袋要密封 | |
| C. | 氯气用于自来水消毒,是因为生成的次氯酸有杀菌、消毒的作用 | |
| D. | 溴化银用于人工降雨,单质碘加入食盐中用于制加碘盐 |
| A. | Al2(SO4)3溶液滴加氨水产生白色胶状沉淀:Al3++3OH-=Al(OH)3↓ | |
| B. | 纯碱溶液使酚酞变红:CO32-+2H2O?H2CO3+2OH- | |
| C. | 乙酸清除水垢后的化学反应原理:2H++CO32-=CO2↑+H2O | |
| D. | FeCl3溶液中加入足量铁粉,溶液由黄色变成浅绿色:2Fe3++Fe=3Fe2+ |
①铝用于软包装是利用了铝密度小的物理性质
②在加热条件下,FeO可以迅速变成Fe2O3
③合金材料可能含有非金属元素
④合成纤维和光导纤维都是新型无机非金属材料
⑤高纯度的硅广泛用于制作计算机芯片
⑥不能用自来水直接配制AgNO3溶液
⑦粗铜精炼时,纯铜与外电源的正极相连
⑧在金属元素和非金属元素的分界线附近可以寻找制备半导体材料的元素.
| A. | 仅②③④⑤⑥⑧ | B. | 仅③⑤⑥⑧ | C. | 仅①②④⑦ | D. | 除①外 |
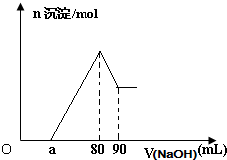 将一块镁铝合金投入一定体积的1mol/L稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图.下列说法中不正确的是( )
将一块镁铝合金投入一定体积的1mol/L稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图.下列说法中不正确的是( )| A. | 由图可以确定该镁铝合金中铝的质量为0.27 g | |
| B. | 由图可以确定该合金中两元素的物质量之比的最大值为4 | |
| C. | 当滴入1mol/L的NaOH溶液85mL时,所得沉淀的成分为Mg(OH)2和Al(OH)3 | |
| D. | 由图可以确定a的取值范围为:0≤a≤50 |
| A. | 钠与水反应 Na+H2O═Na++OH-+H2↑ | |
| B. | 碳酸钠与稀硫酸反应CO32-+2H+═CO2↑+H2O | |
| C. | 氢氧化铜与稀硫酸反应OH-+H+═H2O | |
| D. | 铁与盐酸反应2Fe+6H+═2Fe3++3H2↑ |
 H++OH-、HCO3-+H2O
H++OH-、HCO3-+H2O +H2CO3+OH-、HCO3-+H2O
+H2CO3+OH-、HCO3-+H2O H3O++CO32-
H3O++CO32- 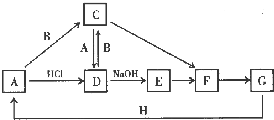 A~H 是中学化学中常见的物质,转化关系如下图所示(部分反应物、反应条件和产物已略去).A、H 是常见的金属单质,工业上常用电解法冶炼H;通常状况下B 为黄绿色气体;G 为红棕色固体;C、D、E、F、G 物种化合物含有同一种元素.
A~H 是中学化学中常见的物质,转化关系如下图所示(部分反应物、反应条件和产物已略去).A、H 是常见的金属单质,工业上常用电解法冶炼H;通常状况下B 为黄绿色气体;G 为红棕色固体;C、D、E、F、G 物种化合物含有同一种元素. .
.