题目内容
5.电镀废水中常含有NaCN,工业上规定其含量低于0.5mg/L才可排放,对NaCN超标的废水可用两段氧化法处理: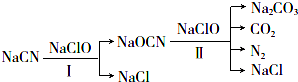
己知:HCN的酸性比碳酸的酸性弱,有剧毒;HCN、HOCN中N元素的化合价相同.
请回答下列问题:
(1)第一次氧化时,溶液的pH应调节为碱性(填“酸性”、“碱性”或“中性”);原因是防止生成HCN,造成人员中毒或污染空气.反应中,欲使1mol NaCN变为NaOCN,则需要氧化剂NaClO至少为1mol.
(2)写出第二次氧化时发生反应的离子方程式:2OCN-+3C1O-=CO2↑+CO32-+3Cl-+N2↑.反应中被氧化的元素是氮.
(3)处理10m3含NaCN 10.3mg/L的废水,实际至少需NaClO1490g(实际用量应为理论值的4倍),才能使废水中NaCN含量达到排放标准.
分析 (1))NaCN易与酸发生反应生成HCN,而HCN有剧毒,故应该使溶液的pH呈碱性;NaCN与NaClO反应生成NaOCN和NaCl,根据反应方程式计算;
(2)反应中氯元素的化合价从+1价降低到-1价,得到2个电子.N元素化合价从-3价升高到0价,失去3个电子,结合氧化还原反应中化合价升降相等配平;
(3)参加反应的NaCN为$\frac{100(10.3-0.5)g}{49g/mol}$=20mol,反应中C由+2价升高到+4价,N元素化合价从-3价升高到0价,即1molNaCN失去5mol电子,1mol次氯酸钠得到2mol电子,利用电子守恒计算.
解答 解:(1)NaCN易与酸反应生成HCN,为防止生成HCN,造成人员中毒或污染空气,因此第一次氧化时,溶液的pH应调节为碱性;NaCN与NaClO反应生成NaOCN和NaCl,其反应方程式为:NaCN+NaClO=NaOCN+NaCl,所以欲使1molNaCN变为NaOCN,则需要氧化剂NaClO为1mol;
故答案为:碱性;防止生成HCN,造成人员中毒或污染空气;1;
(2)反应中氯元素的化合价从+1价降低到-1价,得到2个电子.N元素化合价从-3价升高到0价,失去3个电子,则根据电子得失守恒可知还原剂和氧化剂的物质的量之比是2:3,反应的离子方程式为:2OCN-+3ClO-=CO32-+CO2↑+3Cl-+N2↑,氮元素被氧化.
故答案为:2OCN-+3ClO-=CO32-+CO2↑+3Cl-+N2↑;氮;
(3)参加反应的NaCN是:$\frac{100(10.3-0.5)g}{49g/mol}$=20mol,反应中C由+2价升高到+4价,N元素化合价从-3价升高到0价,即1molNaCN失去5mol电子,1mol次氯酸钠得到2mol电子,所以处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO的质量为:$\frac{20mol×5}{2}$×74.5g/mol×4=1490g,
故答案为:1490.
点评 本题考查了氧化还原反应方程式书写、计算等,题目难度中等,明确氧化还原反应的实质及配平原则为解答关键,试题知识点较多,充分考查了学生的分析能力及灵活应用能力.

 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案| A. | 甲酸甲酯 | B. | 甲酸乙酯 | C. | 乙酸乙酯 | D. | 乙酸甲酯 |
①铝用于软包装是利用了铝密度小的物理性质
②在加热条件下,FeO可以迅速变成Fe2O3
③合金材料可能含有非金属元素
④合成纤维和光导纤维都是新型无机非金属材料
⑤高纯度的硅广泛用于制作计算机芯片
⑥不能用自来水直接配制AgNO3溶液
⑦粗铜精炼时,纯铜与外电源的正极相连
⑧在金属元素和非金属元素的分界线附近可以寻找制备半导体材料的元素.
| A. | 仅②③④⑤⑥⑧ | B. | 仅③⑤⑥⑧ | C. | 仅①②④⑦ | D. | 除①外 |
| A. | 苯甲酸共有四个同分异构体(含苯环且包括苯甲酸) | |
| B. | 相同条件下的沸点:乙二醇>乙醇>乙烷>甲烷 | |
| C. | CH3COOCH3在核磁共振氢谱中有两种不同类型的氢原子 | |
| D. | 两种不同的氨基酸在缩聚反应时可生成不少于4种的聚合物 |
| A. | Na+Ba2+ SO42- OH- | B. | Ag+ NO3? Cl?K+ | ||
| C. | H+ NO3-Fe2+ K+ | D. | Cu2+NH4+OH- SO42- |
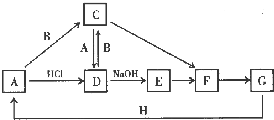 A~H 是中学化学中常见的物质,转化关系如下图所示(部分反应物、反应条件和产物已略去).A、H 是常见的金属单质,工业上常用电解法冶炼H;通常状况下B 为黄绿色气体;G 为红棕色固体;C、D、E、F、G 物种化合物含有同一种元素.
A~H 是中学化学中常见的物质,转化关系如下图所示(部分反应物、反应条件和产物已略去).A、H 是常见的金属单质,工业上常用电解法冶炼H;通常状况下B 为黄绿色气体;G 为红棕色固体;C、D、E、F、G 物种化合物含有同一种元素. .
.