题目内容
对于N2O4(g)?2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示.a.b.c.d.e各状态中,υ正<υ逆是( )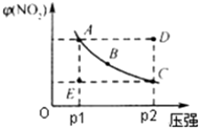

| A、abc | B、e | C、cd | D、d |
考点:产物的百分含量随浓度、时间的变化曲线
专题:化学平衡专题
分析:根据图可知,在曲线上的各点都处于平衡状态,正逆反应速率相等,而D位于曲线上方,即二氧化氮的百分含量高于平衡状态,反应要逆向进行,进而达到平衡状态,E点位于曲线下方,即二氧化氮的百分含量低于平衡状态,反应要正向进行,进而达到平衡状态,据此判断.
解答:
解:根据图可知,在曲线上的各点都处于平衡状态,正逆反应速率相等,而D位于曲线上方,即二氧化氮的百分含量高于平衡状态,反应要逆向进行,进而达到平衡状态,E点位于曲线下方,即二氧化氮的百分含量低于平衡状态,反应要正向进行,进而达到平衡状态,故D点时υ正<υ逆,
故选D.
故选D.
点评:本题考查化学平衡图象问题,题目难度中等,本题注意把握图象曲线的特点以及线外的点与反应所处的状态的关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知:Cu+2Fe3+=Cu2++2Fe2+;Zn+2Fe3+=2Fe2++Zn2+.现将等物质的量的CuSO4、FeCl3和Zn于水中充分反应,所得混合物中除了SO42-、Cl-外,还含有( )
| A、Zn2+、Fe3+、Cu |
| B、Cu2+、Fe3+、Zn |
| C、Zn2+、Cu2+、Fe2+、Fe |
| D、Zn2+、Fe2+、Cu2+、Cu |
实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3?10H2O的质量分别是( )
| A、1000mL,212g |
| B、950mL,543.4g |
| C、1000mL,572g |
| D、500mL,286g |
下列有关化学用语使用正确的是( )
A、质量数为35的氯原子:
| ||
B、BaSO4的电离方程式:BaSO4=Ba2++S
| ||
| C、乙烯的结构简式:C2H4 | ||
D、氯原子结构示意图: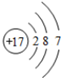 |
下列反应的产物中,一定能与KSCN溶液作用使溶液变红色的是( )
| A、铁与氯气 |
| B、铁与盐酸 |
| C、铁与氯化铁溶液 |
| D、铁与稀硝酸 |
氢气、甲烷的热化学方程式分别为:2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ?mol-1CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-89.3kJ?mol-1将氢气、甲烷按一定比例混合,所得气体密度是相同条件下氮气密度的一半,则9.8g该混合气体完全燃烧放出的热量为( )
| A、28.58kJ |
| B、82.16 kJ |
| C、53.58 kJ |
| D、89.3 kJ |