题目内容
已知:Cu+2Fe3+=Cu2++2Fe2+;Zn+2Fe3+=2Fe2++Zn2+.现将等物质的量的CuSO4、FeCl3和Zn于水中充分反应,所得混合物中除了SO42-、Cl-外,还含有( )
| A、Zn2+、Fe3+、Cu |
| B、Cu2+、Fe3+、Zn |
| C、Zn2+、Cu2+、Fe2+、Fe |
| D、Zn2+、Fe2+、Cu2+、Cu |
考点:离子反应发生的条件
专题:离子反应专题
分析:根据反应方程式可知,氧化性:Fe3>Cu2+,锌先与氯化铁反应,剩余的锌再与硫酸铜反应,根据CuSO4、FeCl3和Zn的物质的量及反应方程式Zn+2FeCl3=ZnCl2+2FeCl2、Zn+CuSO4=ZnSO4+Cu,判断过量情况及反应后存在的物质.
解答:
解:把相同物质的量的CuSO4、FeCl3和Zn置于水中充分反应,设它们的物质的量都为1mol,
根据反应顺序判断:先是锌与铁离子反应,反应的方程式为:Zn+2FeCl3=ZnCl2+2FeCl2,1mol氯化铁完全反应消耗0.5mol锌,剩余的0.5mol锌发生反应:Zn+CuSO4=ZnSO4+Cu,0.5mol锌完全反应消耗0.5mol硫酸铜,反应后生成0.5mol铜,溶液中还剩余0.5mol硫酸铜,
即:反应所得混合物中除含有SO42-和Cl-外,还含有Zn2+、Cu、Cu2+、Fe2+,
故选D.
根据反应顺序判断:先是锌与铁离子反应,反应的方程式为:Zn+2FeCl3=ZnCl2+2FeCl2,1mol氯化铁完全反应消耗0.5mol锌,剩余的0.5mol锌发生反应:Zn+CuSO4=ZnSO4+Cu,0.5mol锌完全反应消耗0.5mol硫酸铜,反应后生成0.5mol铜,溶液中还剩余0.5mol硫酸铜,
即:反应所得混合物中除含有SO42-和Cl-外,还含有Zn2+、Cu、Cu2+、Fe2+,
故选D.
点评:本题考查了金属活动性顺序的应用、离子反应发生条件,题目难度不大,注意掌握氧化还原反应中氧化性、还原性强弱的判断方法,明确铁离子、铜离子参与反应的先后顺序是解答本题的关键.

练习册系列答案
相关题目
已知在相同状况下,同一化学键断裂需要吸收的能量等于形成该化学键放出的能量.下列说法错误的是( )
| A、电解熔融的Al2O3可以制得金属铝和氧气,该反应是一个放出能量的反应 |
| B、H2(g)+F2(g)=2HF(g)△H=-270 kJ/mol,1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量 |
| C、相同状况下,反应2SO2+O2=2SO3是一个放热反应,则反应2SO3=2SO2+O2是一个吸热反应 |
| D、破坏1 mol氢气中的化学键消耗的能量为Q1 kJ,破坏1 mol氯气中的化学键消耗的能量为Q2 kJ,形成1 mol氯化氢中的化学键释放的能量为Q3 kJ,则Q1+Q2<2Q3 |
香柠檬油可用于化妆品.香柠檬油含微量的香柠檬酚和香柠檬醚,其结构如图.下列说法正确的是( )
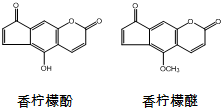

| A、香柠檬醚分子式为C13H9O4 |
| B、香柠檬醚最多可与7 mol H2发生加成反应 |
| C、1 mol香柠檬酚与溴水发生取代反应,最多消耗3 mol Br2 |
| D、1 mol香柠檬酚与NaOH溶液反应,最多消耗3 mol NaOH |
下列关于氮的叙述中正确的是( )
| A、氮分子为极性分子 |
| B、氮气的性质活泼,在常温下能与H2、O2等非金属反应 |
| C、液氮可作制冷 |
| D、氮有多种化合价 |
下列各组离子中,每个离子都能影响水的电离平衡的一组是( )
| A、Zn2+、Ag+、HCO3-、Cl-、PO43-、SO42- |
| B、Fe3+、Br-、Al3+、H+、CO32-、H2PO4- |
| C、Ag+、SO32-、SiO32-、Fe2+、S2- |
| D、Fe2+、ClO-、OH-、HS-、Cu2+、HSO3- |
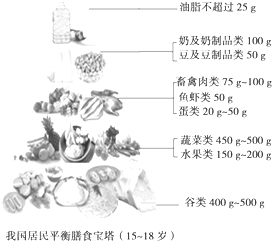 《2011中国居民膳食指南》,该书由一般人群膳食指南、特定人群膳食指南和平衡膳食宝塔三部分组成.仔细研究中国居民平衡膳食宝塔,回答以下问题.
《2011中国居民膳食指南》,该书由一般人群膳食指南、特定人群膳食指南和平衡膳食宝塔三部分组成.仔细研究中国居民平衡膳食宝塔,回答以下问题.