题目内容
 某同学通过查阅资料得知:铝和氧化铁在高温下反应所得到的熔融物应该是铁铝合金.
某同学通过查阅资料得知:铝和氧化铁在高温下反应所得到的熔融物应该是铁铝合金.(1)写出铝和氧化铁在高温下反应的化学方程式:
(2)设计一个最简单的实验方案,证明上述所得的块状熔融物中含有金属铝.写出表示该实验原理的离子方程式:
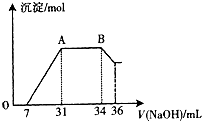
(3)某同学取一定量上述的熔融物与过量的、且很稀的硝酸充分反应,发现反应过程中无气体放出.在反应结束后的溶 液中,逐滴加入4mo1?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mo1)的关系如图所示.在AB段,有刺激性气味的气体产生.试回答下列问题:
①熔融物与稀硝酸充分反应后,还原产物为
②熔融物中金属铝和金属铁的物质的量的之比为
考点:探究物质的组成或测量物质的含量,化学方程式的有关计算,铝的化学性质
专题:计算题
分析:(1)铝与氧化铁在高温条件下生成铁与氧化铝;
(2)利用铝与氢氧化钠反应生成偏铝酸钠与氢气证明;
(3)熔融物为铝铁合金,与过量稀HNO3反应,生成Al3+、Fe3+,H+ 过量且无气体产生,说明NO3-被还原为NH4+,即阳离子有H+、Al3+、Fe3+、NH4+.分析图象可知,7 mL NaOH溶液用于中和H+,31mL-7mL=24 mL NaOH溶液用于沉淀Al3+、Fe3+,34 mL-31 mL=3 mL NaOH溶液用于与NH4+反应,36 mL-34 mL=2 mL NaOH溶液用于溶解Al(OH)3,结合方程式与原子守恒计算.
(2)利用铝与氢氧化钠反应生成偏铝酸钠与氢气证明;
(3)熔融物为铝铁合金,与过量稀HNO3反应,生成Al3+、Fe3+,H+ 过量且无气体产生,说明NO3-被还原为NH4+,即阳离子有H+、Al3+、Fe3+、NH4+.分析图象可知,7 mL NaOH溶液用于中和H+,31mL-7mL=24 mL NaOH溶液用于沉淀Al3+、Fe3+,34 mL-31 mL=3 mL NaOH溶液用于与NH4+反应,36 mL-34 mL=2 mL NaOH溶液用于溶解Al(OH)3,结合方程式与原子守恒计算.
解答:
解:(1)铝与氧化铁在高温条件下生成铁与氧化铝,反应方程式为:Al+Fe2O3
Fe+Al2O3,
故答案为:Al+Fe2O3
Fe+Al2O3;
(2)利用熔融物与氢氧化钠溶液反应生成,有气体生成说明含有Al,反应离子方程式为:2Al+2H2O+2OH-=2Al2-+3H2↑,
故答案为:2Al+2H2O+2OH-=2Al2-+3H2↑;
(3)熔融物为铝铁合金,与过量稀HNO3反应,生成Al3+、Fe3+、H+ 过量且无气体产生,说明NO3-被还原为NH4+,即阳离子有H+、Al3+、Fe3+、NH4+.分析图象可知,7 mL NaOH溶液用于中和H+,31mL-7mL=24 mL NaOH溶液用于沉淀Al3+、Fe3+,34 mL-31 mL=3 mL NaOH溶液用于与NH4+反应,36 mL-34 mL=2 mL NaOH溶液用于溶解Al(OH)3,
①熔融物为铝铁合金,与过量稀HNO3反应,生成Al3+、Fe3+,H+ 过量且无气体产生,说明NO3-被还原为NH4+,由NH4++OH-=NH3+H2O可知,n(NH4+)=3×10-3 L×4 mol/L=0.012 mol,故还原产物NH4NO3的物质的量为0.012mol,
故答案为:NH4NO3;0.012mol;
②由Al(OH)3+OH-=AlO2-+2H2O可知,n(Al3+)=n(Al)=n[Al(OH)3]=2×10-3 L×4 mol/L=0.008 mol,用于沉淀Al3+ 的NaOH为0.008mol×3=0.024 mol,则n(Fe3+ )=n(Fe)=(0.024L×4 mol/L-0.024mol)÷3=0.024 mol,故n(Al):n(Fe)=0.008mol:0.024mol=1:3,
故答案为:1:3.
| ||
故答案为:Al+Fe2O3
| ||
(2)利用熔融物与氢氧化钠溶液反应生成,有气体生成说明含有Al,反应离子方程式为:2Al+2H2O+2OH-=2Al2-+3H2↑,
故答案为:2Al+2H2O+2OH-=2Al2-+3H2↑;
(3)熔融物为铝铁合金,与过量稀HNO3反应,生成Al3+、Fe3+、H+ 过量且无气体产生,说明NO3-被还原为NH4+,即阳离子有H+、Al3+、Fe3+、NH4+.分析图象可知,7 mL NaOH溶液用于中和H+,31mL-7mL=24 mL NaOH溶液用于沉淀Al3+、Fe3+,34 mL-31 mL=3 mL NaOH溶液用于与NH4+反应,36 mL-34 mL=2 mL NaOH溶液用于溶解Al(OH)3,
①熔融物为铝铁合金,与过量稀HNO3反应,生成Al3+、Fe3+,H+ 过量且无气体产生,说明NO3-被还原为NH4+,由NH4++OH-=NH3+H2O可知,n(NH4+)=3×10-3 L×4 mol/L=0.012 mol,故还原产物NH4NO3的物质的量为0.012mol,
故答案为:NH4NO3;0.012mol;
②由Al(OH)3+OH-=AlO2-+2H2O可知,n(Al3+)=n(Al)=n[Al(OH)3]=2×10-3 L×4 mol/L=0.008 mol,用于沉淀Al3+ 的NaOH为0.008mol×3=0.024 mol,则n(Fe3+ )=n(Fe)=(0.024L×4 mol/L-0.024mol)÷3=0.024 mol,故n(Al):n(Fe)=0.008mol:0.024mol=1:3,
故答案为:1:3.
点评:本题以铝热反应为载体,考查物质组成的确定、化学计算等,(3)中明确各阶段发生的反应是关键,难度中等.

练习册系列答案
相关题目
 右图所示是用稀硫酸与锌反应测定反应速率的装置,在分液漏斗中加入稀硫酸,在锥形瓶中加入锌,通过测定产生一定量气体所用的时间来测定反应的速率.现用50mL 1mol/L硫酸,在锥形瓶中加入下列各种锌(总质量相同),产生H2最快的是( )
右图所示是用稀硫酸与锌反应测定反应速率的装置,在分液漏斗中加入稀硫酸,在锥形瓶中加入锌,通过测定产生一定量气体所用的时间来测定反应的速率.现用50mL 1mol/L硫酸,在锥形瓶中加入下列各种锌(总质量相同),产生H2最快的是( )| A、纯的锌粒 |
| B、纯的锌粉 |
| C、含少量铜杂质的锌粒 |
| D、含少量铜杂质的锌粉 |
亚麻油酸是淡黄色的透明液体,在医疗上可用于治疗高血脂和动脉硬化,花生油中富含亚麻油酸,其结构简式为CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH,下列说法中正确的是( )
| A、亚麻油酸是一种酯类 |
| B、等物质的量的两份亚麻油酸分别和Na、H2反应,消耗二者的物质的量之比为1:1 |
| C、亚麻油酸可以发生氧化、加成、水解等反应 |
| D、亚麻油酸能使溴的CCl4溶液褪色 |


 的名称是
的名称是



