题目内容
有一Fe、FeO、Fe2O3、Fe3O4组成的混合物完全溶解于450mL 1mol/L HNO3溶液中,只收集到标准状况下1.12L NO气体,若向反应后加入1mol/L的NaOH到Fe元素恰好完全沉淀,则需NaOH溶液的体积为 L.
考点:有关混合物反应的计算
专题:计算题
分析:反应中硝酸体现两种性质,一是酸性,以NO3-离子存在溶液中,另一种是氧化性,被还原为NO气体;加入NaOH溶液后,溶液中的溶质为硝酸钠,根据N元素守恒计算.
解答:
解:当所加入的NaOH恰好使铁元素沉淀,此时溶液为硝酸钠溶液,根据N元素守恒可求出NaOH的量,
n(NaOH)=n(NO3-)=n(HNO3)-n(NO)=0.45L×1mol/L-
=0.4mol,
所以向反应后加入1mol/L的NaOH溶液的体积为:V(NaOH)=
=0.4L,
故答案为:0.4.
n(NaOH)=n(NO3-)=n(HNO3)-n(NO)=0.45L×1mol/L-
| 1.12L |
| 22.4L/mol |
所以向反应后加入1mol/L的NaOH溶液的体积为:V(NaOH)=
| 0.4mol |
| 1mol/L |
故答案为:0.4.
点评:本题考查有关混合物的计算,题目难度中等,本题注意根据Na+和NO3-全部结合及硝酸根离子的两个去处计算,试题侧重考查学生的分析与计算能力.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
下列化学用语表示正确的是( )
| A、乙酸的分子式:CH2O |
| B、乙烯的结构简式:CH2CH2 |
C、Cl-的结构示意图: |
D、HBr的形成过程: |
圆明园12生肖铜首在1860年被侵略中国的英法联军掠夺后,至今只有牛首、猴首、虎首、猪首和马首回归中国普通铜器时间稍久就会出现铜绿,但这几件1760年铜铸的国宝在200多年后看上去仍然熠熠生辉.下列对其原因的分析最可能正确的是( )
| A、它们的表面都镀上了一层耐腐蚀的黄金 |
| B、环境污染特别严重,它们表面的铜绿被酸雨溶解洗去 |
| C、铜不易被氧化 |
| D、它们是含一定比例金、银、锡、锌的铜合金 |
某学生将溴乙烷和NaOH溶液共热煮沸几分钟后,冷却,滴入AgNO3溶液,结果未见到预期的现象,其主要原因是( )
| A、加热时间太短 |
| B、加AgNO3溶液前未用稀HNO3酸化 |
| C、应该和NaOH的乙醇溶液共热 |
| D、不应该冷却后再滴入AgNO3溶液 |
 某同学通过查阅资料得知:铝和氧化铁在高温下反应所得到的熔融物应该是铁铝合金.
某同学通过查阅资料得知:铝和氧化铁在高温下反应所得到的熔融物应该是铁铝合金.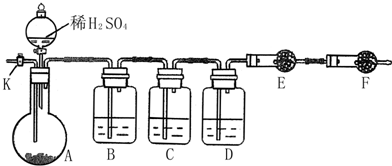 为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g 以如图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g 以如图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)