题目内容
某校课外小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验.[已知Ba(HCO3)2可溶于水]
方案Ⅰ.甲组同学用沉淀分析法,按如下图所示的实验流程进行实验:
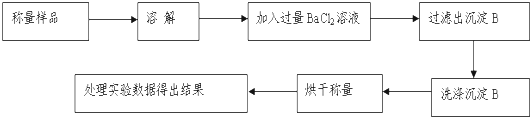
(1)实验时,过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为 .
(2)洗涤沉淀B的操作是 .
(3)若实验中测得样品质量为m g,沉淀质量为n g,则碳酸钠的质量分数为 .
(4)烘干后的沉淀应放在 (仪器名称)中冷却至室温再称量.
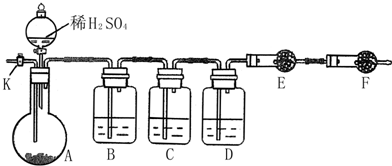
方案Ⅱ:乙组同学的主要实验流程图如下:
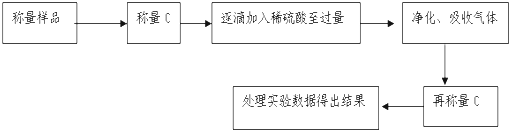
按如下图所示装置进行实验:

(5)该实验中装置B盛放的物质是 ,分液漏斗中如果用盐酸代替硫酸测量结果将 (填“偏大”、“偏小”、“无影响”).
(6)在C中装碱石灰来吸收净化后的气体.D装置的作用是 .
(7)有的同学认为为了减少实验误差,在反应前后都通入N2,反应后通入N2的目的是 .
方案Ⅲ:气体分析法
(8)把一定量样品与足量稀硫酸反应后,用如图装置测量产生CO2气体的体积,B溶液最好采用 (以
下选项中选择)使测量误差较小.

a饱和碳酸钠溶液 b饱和碳酸氢钠溶液c饱和氢氧化钠溶液 d饱和硫酸铜溶液
(9)但选用该溶液后实验结果仍然不够准确,其原因可能是 .
方案Ⅰ.甲组同学用沉淀分析法,按如下图所示的实验流程进行实验:

(1)实验时,过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为
(2)洗涤沉淀B的操作是
(3)若实验中测得样品质量为m g,沉淀质量为n g,则碳酸钠的质量分数为
(4)烘干后的沉淀应放在
方案Ⅱ:乙组同学的主要实验流程图如下:

按如下图所示装置进行实验:

(5)该实验中装置B盛放的物质是
(6)在C中装碱石灰来吸收净化后的气体.D装置的作用是
(7)有的同学认为为了减少实验误差,在反应前后都通入N2,反应后通入N2的目的是
方案Ⅲ:气体分析法
(8)把一定量样品与足量稀硫酸反应后,用如图装置测量产生CO2气体的体积,B溶液最好采用
下选项中选择)使测量误差较小.

a饱和碳酸钠溶液 b饱和碳酸氢钠溶液c饱和氢氧化钠溶液 d饱和硫酸铜溶液
(9)但选用该溶液后实验结果仍然不够准确,其原因可能是
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:方案Ⅰ、样品溶液后加入氯化钡,碳酸钠和氯化钡反应生成碳酸钡沉淀,碳酸氢钠与氯化钡不反应,过滤、干燥得到碳酸钡沉淀,通过碳酸钡沉淀可求出碳酸钠的物质的量,进而求得碳酸钠的质量分数.
(1)过滤时用玻璃棒引流;
(2)根据洗涤沉淀的操作回答;
(3)沉淀n为碳酸钡,根据碳守恒,碳酸钠的物质的量和碳酸钡相等,进而计算质量分数;
(4)烘干后得沉淀应放在干燥器中冷却;
方案Ⅱ、称取一定量样品装入广口瓶中,打并止水夹,缓慢鼓入空气数分钟用来赶净装置中的空气,关闭止水夹,在干燥管内填满碱石灰,称量,缓慢加入稀硫酸至不再产生气体为止,打开止水夹,缓慢鼓入空气数分钟,把生成的二氧化碳全部赶到碱石灰干燥管中全部吸收,再称量干燥管质量,通过碱石灰的增重求得二氧化碳的质量,根据二氧化碳的质量和样品质量求得碳酸钠的物质的量,进而求得质量分数.
(5)装置B的作用是把气体中的水蒸气除去;分液漏斗中如果用盐酸代替硫酸,盐酸易挥发;
(6)空气中的水蒸气和二氧化碳会被碱石灰吸收;
(7)该方案关键是要获得产生的CO2的质量,故应保证产生的二氧化碳完全被吸收,而空气中二氧化碳不能被吸收;
方案Ⅲ、根据样品和硫酸反应,测量产生二氧化碳的体积,进而计算碳酸钠的质量分数.
(8)所选液体不溶解二氧化碳;
(9)部分水残留在玻璃导管内,会使得测得二氧化碳体积偏小.
(1)过滤时用玻璃棒引流;
(2)根据洗涤沉淀的操作回答;
(3)沉淀n为碳酸钡,根据碳守恒,碳酸钠的物质的量和碳酸钡相等,进而计算质量分数;
(4)烘干后得沉淀应放在干燥器中冷却;
方案Ⅱ、称取一定量样品装入广口瓶中,打并止水夹,缓慢鼓入空气数分钟用来赶净装置中的空气,关闭止水夹,在干燥管内填满碱石灰,称量,缓慢加入稀硫酸至不再产生气体为止,打开止水夹,缓慢鼓入空气数分钟,把生成的二氧化碳全部赶到碱石灰干燥管中全部吸收,再称量干燥管质量,通过碱石灰的增重求得二氧化碳的质量,根据二氧化碳的质量和样品质量求得碳酸钠的物质的量,进而求得质量分数.
(5)装置B的作用是把气体中的水蒸气除去;分液漏斗中如果用盐酸代替硫酸,盐酸易挥发;
(6)空气中的水蒸气和二氧化碳会被碱石灰吸收;
(7)该方案关键是要获得产生的CO2的质量,故应保证产生的二氧化碳完全被吸收,而空气中二氧化碳不能被吸收;
方案Ⅲ、根据样品和硫酸反应,测量产生二氧化碳的体积,进而计算碳酸钠的质量分数.
(8)所选液体不溶解二氧化碳;
(9)部分水残留在玻璃导管内,会使得测得二氧化碳体积偏小.
解答:
解:(1)过滤时用玻璃棒引流,故答案为:玻璃棒;
(2)洗涤沉淀的操作是在过滤器中加水浸没沉淀使水自然留下,重复操作2-3次;
故答案为:用玻璃棒引流,注入蒸馏水,直至刚好没过沉淀,待水从漏斗底部自然流完后,重复上述操作2-3次.
(3)沉淀n为碳酸钡,物质的量
=
mol,根据碳守恒,碳酸钠的物质的量和碳酸钡相等,故碳酸钠的物质的量为:
mol,碳酸钠的质量分数为:
×100%=
×100%,故答案为:
×100%;
(4)烘干后得沉淀应放在干燥器中冷却,防止在空气中吸收水分,故答案为:干燥器;
Ⅱ、(5)装置B的作用是把气体中的水蒸气除去,故用浓硫酸来除去水蒸气;分液漏斗中如果用盐酸代替硫酸,盐酸易挥发,这样制得二氧化碳气体中含氯化氢,浓硫酸不能吸收氯化氢,则氯化氢被碱石灰吸收,导致测到二氧化碳质量偏高,等质量碳酸钠和碳酸氢钠,碳酸氢钠产生二氧化碳多,则会导致碳酸氢钠偏多,碳酸钠偏小;故答案为:浓硫酸;偏小;
(6)空气中的水蒸气和二氧化碳会被碱石灰吸收,故D的作用是吸收空气中的水蒸气和二氧化碳,以确保前一个干燥管中质量增加量的准确性;
故答案为:吸收空气中的水蒸气和二氧化碳,以确保前一个干燥管中质量增加量的准确性;
(7)该方案关键是要获得产生的CO2的质量,实验前容器内含有空气,空气中含有二氧化碳,会影响生成的二氧化碳的量,反应后装置中容器内含有二氧化碳,不能被C中碱石灰完全吸收,导致测定结果有较大误差,所以反应前后都要通入N2,反应后通入N2的目的是:排尽装置内的空气,将生成的二氧化碳从容器内排出,被C装置中碱石灰吸收.
故答案为:排尽装置内的空气,将生成的二氧化碳从容器内排出,被C装置中碱石灰吸收.
(8)利用测定反应生成的二氧化碳气体体积的方法测定,在碳酸氢钠溶液中二氧化碳不反应,溶解度减小,利用装置图排饱和碳酸氢钠溶液测定二氧化碳气体的体积,二氧化碳和碳酸钠、氢氧化钠都反应,在硫酸铜溶液中也溶解,故答案为:b;
(9)部分水残留在玻璃导管内,会使得测得二氧化碳体积偏小,故答案为:部分水残留在玻璃导管内.
(2)洗涤沉淀的操作是在过滤器中加水浸没沉淀使水自然留下,重复操作2-3次;
故答案为:用玻璃棒引流,注入蒸馏水,直至刚好没过沉淀,待水从漏斗底部自然流完后,重复上述操作2-3次.
(3)沉淀n为碳酸钡,物质的量
| ng |
| 197g/mol |
| n |
| 197 |
| n |
| 197 |
| ||
| mg |
| 106n |
| 197m |
| 106n |
| 197m |
(4)烘干后得沉淀应放在干燥器中冷却,防止在空气中吸收水分,故答案为:干燥器;
Ⅱ、(5)装置B的作用是把气体中的水蒸气除去,故用浓硫酸来除去水蒸气;分液漏斗中如果用盐酸代替硫酸,盐酸易挥发,这样制得二氧化碳气体中含氯化氢,浓硫酸不能吸收氯化氢,则氯化氢被碱石灰吸收,导致测到二氧化碳质量偏高,等质量碳酸钠和碳酸氢钠,碳酸氢钠产生二氧化碳多,则会导致碳酸氢钠偏多,碳酸钠偏小;故答案为:浓硫酸;偏小;
(6)空气中的水蒸气和二氧化碳会被碱石灰吸收,故D的作用是吸收空气中的水蒸气和二氧化碳,以确保前一个干燥管中质量增加量的准确性;
故答案为:吸收空气中的水蒸气和二氧化碳,以确保前一个干燥管中质量增加量的准确性;
(7)该方案关键是要获得产生的CO2的质量,实验前容器内含有空气,空气中含有二氧化碳,会影响生成的二氧化碳的量,反应后装置中容器内含有二氧化碳,不能被C中碱石灰完全吸收,导致测定结果有较大误差,所以反应前后都要通入N2,反应后通入N2的目的是:排尽装置内的空气,将生成的二氧化碳从容器内排出,被C装置中碱石灰吸收.
故答案为:排尽装置内的空气,将生成的二氧化碳从容器内排出,被C装置中碱石灰吸收.
(8)利用测定反应生成的二氧化碳气体体积的方法测定,在碳酸氢钠溶液中二氧化碳不反应,溶解度减小,利用装置图排饱和碳酸氢钠溶液测定二氧化碳气体的体积,二氧化碳和碳酸钠、氢氧化钠都反应,在硫酸铜溶液中也溶解,故答案为:b;
(9)部分水残留在玻璃导管内,会使得测得二氧化碳体积偏小,故答案为:部分水残留在玻璃导管内.
点评:本题考查了物质性质的探究和组成分析判断,主要是实验过程的分析,掌握基本操作和测定原理是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
圆明园12生肖铜首在1860年被侵略中国的英法联军掠夺后,至今只有牛首、猴首、虎首、猪首和马首回归中国普通铜器时间稍久就会出现铜绿,但这几件1760年铜铸的国宝在200多年后看上去仍然熠熠生辉.下列对其原因的分析最可能正确的是( )
| A、它们的表面都镀上了一层耐腐蚀的黄金 |
| B、环境污染特别严重,它们表面的铜绿被酸雨溶解洗去 |
| C、铜不易被氧化 |
| D、它们是含一定比例金、银、锡、锌的铜合金 |
 某同学通过查阅资料得知:铝和氧化铁在高温下反应所得到的熔融物应该是铁铝合金.
某同学通过查阅资料得知:铝和氧化铁在高温下反应所得到的熔融物应该是铁铝合金.
 为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g 以如图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g 以如图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)