题目内容
7.下列说法错误的是( )| A. | 向0.1 mol•L-1的CH3COOH溶液中加入少量碳酸钙固体,溶液的pH增大 | |
| B. | 室温下,pH=4的NaHSO4溶液中,水电离出的H+浓度为1×10-10 mol•L-1 | |
| C. | 浓度均为0.1 mol•L-1的HCN溶液和NaCN溶液等体积混合(忽略体积变化),溶液中c(HCN)+c(CN-)=0.1 mol•L-1 | |
| D. | pH相同的①NH4Cl、②NH4Al(SO4)2、③(NH4)2SO4三种溶液的c(NH${\;}_{4}^{+}$):②<③<① |
分析 A.醋酸与碳酸钙反应,导致醋酸浓度减小,溶液中氢离子浓度减小;
B.硫酸氢钠电离出的氢离子抑制了水的电离,溶液中的氢氧根离子是水电离的;
C.根据混合液中的物料守恒判断;
D.溶液中氢离子主要是铵根离子水解产生的,溶液pH相同时,①③溶液中铵根离子浓度相同,②中铝离子溶液呈酸性,则pH相同时②中铵根离子浓度最小.
解答 解:A.向0.1 mol•L-1的CH3COOH溶液中加入少量碳酸钙固体,醋酸浓度减小,溶液中氢离子浓度减小,溶液的pH增大,故A正确;
B.室温下,pH=4的NaHSO4溶液抑制了水的电离,溶液中氢氧根离子是水电离大量,则水电离出的H+浓度为:$\frac{1×1{0}^{-14}}{1×1{0}^{-4}}$mol/L=1×10-10 mol•L-1,故B正确;
C.浓度均为0.1 mol•L-1的HCN溶液和NaCN溶液等体积混合(忽略体积变化),根据溶液中的物料守恒可得:c(HCN)+c(CN-)=0.1 mol•L-1,故C正确;
D.①NH4Cl、③(NH4)2SO4中铵根离子正常水解,溶液中氢离子主要是铵根离子水解产生的,则pH相同时两溶液中铵根离子浓度相同;②NH4Al(SO4)2铝离子水解溶液呈酸性,若pH相同时,②中铵根离子浓度最小,所以三种溶液中铵根离子浓度大小为:①=③>②,故D错误;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响因素为解答关键,注意掌握物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
14.下列各项表述正确的是( )
| A. | 已知H2燃烧热△H为-285.8kJ/mol,则:2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ/mol | |
| B. | 已知稀盐酸与NaOH稀溶液反应的中和热△H为-57.3kJ/mol,则:H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=-57.3kJ/mol | |
| C. | 电解稀硫酸可能发生反应:Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑ | |
| D. | 以石墨为电极电解MgCl2溶液的总离子方程式:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- |
18.在以下电解槽中,随电解的进行,溶液的pH值会减小的是( )
| A. | 铜为阳极、铜为阴极,电解液为CuSO4溶液 | |
| B. | 石墨为阳极、铁为阴极,电解液为CuSO4溶液 | |
| C. | 铁为阳极,铜为阴极,电解液为AgNO3溶液 | |
| D. | 石墨为阳极,铁为阴极,电解液为NaCl溶液 |
2.下列说法正确的是( )
| A. | 目前使用的燃料液化石油气,其主要成分均属于烯烃 | |
| B. | 食用白糖的主要成分是蔗糖,小苏打的主要成分是碳酸钠 | |
| C. | 用碱式滴定管量取20.00mL0.1mol/LKMnO4溶液 | |
| D. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 |
19.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 工业上常用电解法制备元素C、D、E的单质 | |
| B. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | 化合物AE与CE具有相同类型的化学键 | |
| D. | 元素A、B组成的化合物常温下一定呈气态 |
16.元素周期表和元素周期律是学习化学的重要工具,可以帮助我们推测元素及其化合物的结构和性质,对工农业生产具有一定的指导意义.下表是元素周期表的部分片段(2、3周期).
根据上表回答下列问题(请使用具体元素符号或化学式,不能用编号回答问题):
(1)8种元素中,金属性最强的是Na,化学性质最不活泼的是Ar
(2)由①、④与氧三种元素形成的化合物,其水溶液洗涤油污物品时,用热的水溶液去油污的效果比较好.请解释“用热的水溶液去油污的效果比较好”的原因加热促进纯碱水解,使OH-浓度增大,增强了去油污的能力
(3)④元素形成的多种同素异形体,有广泛的用途.请写出其中任意两种同素异形体的名称:金刚石 和石墨
(4)写出①的最高价氧化物对应水化物与⑤的最高价氧化物对应水化物反应的化学方程式NaOH+HNO3=NaNO3+H2O
(5)某同学做同周期元素性质递变规律实验时,设计了如下实验并记录了有关实验现象.
请你根据上表得出实验结论:金属性:Na>Mg>Al;若比较⑥与⑦的单质的活泼性,请写出实验方案向Na2S或H2S溶液中通入Cl2,若观察到有淡黄色混浊,则活泼性Cl2强于S(或HCl比H2S稳定).
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ④ | ⑤ | ||||||
| 3 | ① | ② | ③ | ⑥ | ⑦ | ⑧ |
(1)8种元素中,金属性最强的是Na,化学性质最不活泼的是Ar
(2)由①、④与氧三种元素形成的化合物,其水溶液洗涤油污物品时,用热的水溶液去油污的效果比较好.请解释“用热的水溶液去油污的效果比较好”的原因加热促进纯碱水解,使OH-浓度增大,增强了去油污的能力
(3)④元素形成的多种同素异形体,有广泛的用途.请写出其中任意两种同素异形体的名称:金刚石 和石墨
(4)写出①的最高价氧化物对应水化物与⑤的最高价氧化物对应水化物反应的化学方程式NaOH+HNO3=NaNO3+H2O
(5)某同学做同周期元素性质递变规律实验时,设计了如下实验并记录了有关实验现象.
| 实验步骤 | 实验现象 |
| A、将一小块单质①放入滴有酚酞溶液 的冷水中 | 剧烈反应,①浮于水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| B、将单质②投入冷水中,观察现象, 再将水加热 | 开始无现象,加热后有气体产生 |
| C、将单质②投入稀盐酸中 | 迅速产生大量无色气体 |
| D、将单质③投入稀盐酸中 | 反应不十分剧烈,产生无色气体 |
 HClO+H++Cl-.
HClO+H++Cl-.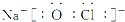 .
. .
.