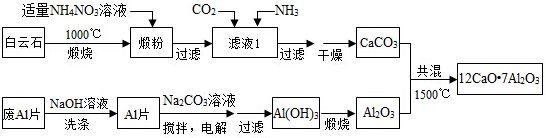
��Ŀ����
12���о�CO2�ں����е�ת�ƺ��ޣ��ǵ������ѧ�о���ǰ��������1�����ں�ˮ��CO2��Ҫ��4����̼��ʽ���ڣ�����HCO${\;}_{3}^{-}$ռ95%��д��CO2����ˮ����HCO${\;}_{3}^{-}$�ķ���ʽ��CO2+H2O?H2CO3��H2CO3?H++HCO3-��
��2���ں���̼ѭ���У�ͨ����ͼ��ʾ��;����̼��
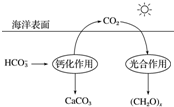
��д���ƻ����õ����ӷ���ʽ��2HCO3-+Ca2+=CaCO3��+CO2��+H2O��
��ͬλ��ʾ�ٷ�֤ʵ��������ͷų���O2ֻ������H2O����18O������ʵĹ�����õĻ�ѧ����ʽ���£����䲹��������CO2+H218O$\frac{\underline{\;\;\;����\;\;\;}}{Ҷ����}$��CH2O��x+x18O2+xH2O
��3����ˮ���ܽ���̼ռ��ˮ��̼��95%���ϣ���ȷ�������о�����̼ѭ���Ļ����������ܽ���̼���ɲ������·�����
�����ᡢ����CO2����N2���ữ��ĺ�ˮ�д���CO2���ü�Һ���գ�װ��ʾ��ͼ��ͼ���������߿��е�װ�ò�����������������Լ���
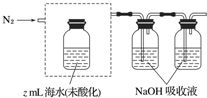
�ڵζ���������Һ���յ���̼ת��ΪNaHCO3������x mol•L-1 HCl��Һ�ζ�������y mL HCl��Һ����ˮ���ܽ���̼��Ũ��=$\frac{x•y}{2}$ mol•L-1��
��4��������ͼ��ʾװ�ôӺ�ˮ����ȡCO2�������ڼ��ٻ����������庬����
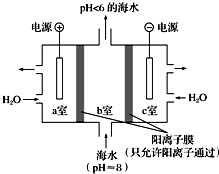
�ٽ�Ϸ���ʽ������ȡCO2��ԭ����a�ң�2H2O-4e=4H++O2����������ͨ�������ӽ���Ĥ����b�ң�������Ӧ��H++HCO3-=CO2��+H2O��
���ø�װ�ò��������ʴ���b���ų��ĺ�ˮ���ϸ���Żش��������ϸ�ķ�����c�ң�2H2O+2e-=2OH-+H2������c���ų��ļ�Һ����b���ų������Ժ�ˮ������װ����ں�ˮ��pH��
���� ��1��������̼����ˮ����̼�ᣬ̼��Ϊ���ᣬ���ֵ�������̼�������
��2������ͼ��֪���˹���̼�����ת������̼��ƣ��ݴ���д����ʽ��
�ڹ�������Ƕ�����̼��ˮ��̫���������£���Ҷ�����з�Ӧ�����л���ų������Ĺ��̣�������Դ��ˮ�е������ݴ˽��
��3�����������֪������ữ��ĺ�ˮ�д���������̼����ô��Ҫ�μ�ϡ���ữ����װ����Ӧ�ӳ��ܴ��뵪�����Ӷ̹ܴ���������̼���ݴ˽�ɣ�
������ԭ��NaHCO3+HCl=NaCl+CO2��+H2O��ɣ�
��4��a�ҽӵ�Դ��������Ϊ������ˮʧȥ�������������������ӣ�������ͨ�������ӽ���Ĥ����b�ң���b���е�̼�������Ӧ���ɶ�����̼���壬�ݴ˽�ɣ�
��c�����ӵ�Դ�ĸ�����Ϊ������ˮ�õ�����������������������a���в��������ӣ���c���ų��ļ�Һ����b���ų������Ժ�ˮ���ڼ��ɣ��ݴ˽��
��� �⣺��1��������̼����ˮ���ɵ�̼��Ϊ���ᣬ���ֵ�������̼��������йط���ʽΪ��CO2+H2O?H2CO3��H2CO3?H++HCO3-��
�ʴ�Ϊ��CO2+H2O?H2CO3��H2CO3?H++HCO3-��
��2���ٷ�Ӧ���к���̼�������������Ϊ̼��ƣ�����Ԫ���غ��Լ�����غ�ó�����ʽΪ��2HCO3-+Ca2+=CaCO3��+CO2��+H2O��
�ʴ�Ϊ��2HCO3-+Ca2+=CaCO3��+CO2��+H2O��
�ڹ�����ò�����������Դ��ˮ����ˮ�е���ԭ�Ӳ���ʾ�ٷ����Ϊ18O������Ԫ���غ���ƽӦ��ҪCO2��H218O���ʴ�Ϊ��CO2��H218O��
��3�����ữ��ˮ������ʹ���Լ���ϡ���ᣬ���÷�Һ©���μӣ����ܽ������̹ܳ�������װ��Ϊ��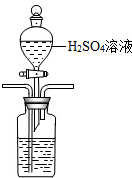 ��
��
�ʴ�Ϊ��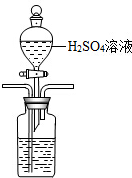 ��
��
�ڴ˷�Ӧԭ��Ϊ��NaHCO3+HCl=NaCl+CO2��+H2O����̼����������������ʵ���֮��Ϊ1��1����ô��ˮ��̼�����Ƶ�Ũ��Ϊc�������ΪmL������������c��z=xy����c=$\frac{x•y}{2}$���ʴ�Ϊ��$\frac{x•y}{2}$��
��4��a�ң�2H2O-4e-=4H++O2����������ͨ�������ӽ���Ĥ����b�ң�������Ӧ��H++HCO3-=CO2��+H2O��
�ʴ�Ϊ��a�ң�2H2O-4e=4H++O2����������ͨ�������ӽ���Ĥ����b�ң�������Ӧ��H++HCO3-=CO2��+H2O��
���ø�װ�ò��������ʴ���b���ų��ĺ�ˮ���ϸ���Żش��������ϸ�ķ����ǣ�c�ң�2H2O+2e-=2OH-+H2������c���ų��ļ�Һ����b���ų������Ժ�ˮ������װ����ں�ˮ��pH��
�ʴ�Ϊ��c�ң�2H2O+2e-=2OH-+H2������c���ų��ļ�Һ����b���ų������Ժ�ˮ������װ����ں�ˮ��pH��
���� ������Ҫ������Ǻ�ˮ���ۺ������Լ�ԭ��غ͵��صĹ���ԭ�����������������Ϣ�ǽ������Ĺؼ�����Ŀ�ѶȽϴ�

| A�� | ԭ��������E��D��B��C��A | B�� | ԭ�Ӱ뾶��D��E��A��C��B | ||
| C�� | ����⻯������ȶ��ԣ�C��B��A | D�� | ���Ӱ뾶��C-��D+��E3+��B2- |
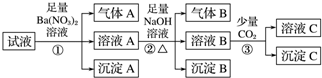
| A�� | ԭ��Һ��һ����Fe2+��SO42-��H+��NH4+��Al3+ | |
| B�� | ԭ��Һ��һ��û��Ba2+��CO32-��NO3- | |
| C�� | ������з�Ӧ�����ӷ���ʽΪ2AlO-+CO2+3H2O�T2Al��OH��3��+CO32- | |
| D�� | ����A��B֮��϶����ܷ�����Ӧ |
 �о������ḻ��CO2��ȫ������Ϊ��̼Դ�������ǰӦ����㷺��̼Դ��ʯ�ͺ���Ȼ��������������Ҷ���ݽߵ�Σ����ͬʱ�ֿɻ�����CO2�ۻ�������������ЧӦ��ʵ��CO2������ѭ����
�о������ḻ��CO2��ȫ������Ϊ��̼Դ�������ǰӦ����㷺��̼Դ��ʯ�ͺ���Ȼ��������������Ҷ���ݽߵ�Σ����ͬʱ�ֿɻ�����CO2�ۻ�������������ЧӦ��ʵ��CO2������ѭ������1��Ŀǰ��ҵ����һ�ַ�������CO2��H2��230����������������ת�����ɼ״�������ˮ��������ͼ��ʾ��ѹ������0.5mol CO2��1.5mol H2ת���ʴ�80%ʱ�������仯ʾ��ͼ�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������bd������ĸ����
a��������ѹǿ����
b��H2�������������
c��c��H2��=3c��CH3OH��
d���������ܶȲ���
e��2��C=O���ѵ�ͬʱ��6��H-H����
��2������ͬ����CO��g����H2O��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�ӦCO��g��+H2O��g��?CO2��g��+H2��g�����õ������������ݣ�
| ʵ���� | �¶� �� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
��ʵ��3�У���ƽ��ʱ��CO��ת���ʴ���ˮ��������a/b��ֵ�������ֵ��ȡֵ��Χ����
��ʵ��4����900��ʱ���ڴ������м���CO��H2O��CO2��H2��Ϊ1mol�����ʱv��������v���棩�������������������=��������
��3����֪�ڳ��³�ѹ�£�
��2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��g����H=-1275.6kJ/mol
��2CO��g��+O2��g��=2CO2��g����H=-566.0kJ/mol
��H2O��g��=H2O��l����H=-44.0kJ/mol
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽCH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-442.8kJ/mol
��4����֪������һ�ֶ�Ԫ���ᣬ�������ƣ�NaHC2O4����Һ�����ԣ������£���10mL 0.0l mol��L-l H2C2O4��Һ�еμ�10mL 0.01mol��L-l NaOH��Һʱ���Ƚ���Һ�и�������Ũ�ȵĴ�С��ϵc��Na+����c��HC2O4-����c��H+����c��C2O42-����c��OH-����
��5���Լ��ѡ�����������������ҺΪԭ�ϣ�ʯīΪ�缫�ɹ���ȼ�ϵ�أ��õ�صĸ�����Ӧʽ
ΪCH3OCH3+16OH--12e-=2CO32-+11H2O��
| A�� | ��0.1 mol•L-1��CH3COOH��Һ�м�������̼��ƹ��壬��Һ��pH���� | |
| B�� | �����£�pH=4��NaHSO4��Һ�У�ˮ�������H+Ũ��Ϊ1��10-10 mol•L-1 | |
| C�� | Ũ�Ⱦ�Ϊ0.1 mol•L-1��HCN��Һ��NaCN��Һ�������ϣ���������仯������Һ��c��HCN��+c��CN-��=0.1 mol•L-1 | |
| D�� | pH��ͬ�Ģ�NH4Cl����NH4Al��SO4��2���ۣ�NH4��2SO4������Һ��c��NH${\;}_{4}^{+}$�����ڣ��ۣ��� |
| A�� | ���ͷ�����Ҫ����̼�����ƣ���ʹ���Ƴ��ĸ�����ɶ�� | |
| B�� | �Ȳ�����ʱ���ӷ�ά����C��Ч�����ã�ԭ����ά����C���������� | |
| C�� | ʳ�û����ͺͼ����嶼�ܷ���ˮ�ⷴӦ | |
| D�� | ���ع��͡����ӹ���������������������������� |
| X | L���������K���������3�� |
| Y | ������Ӳ�������ԭ������ |
| Z | L���������K���M�������֮�� |
| W | �������Ե����γ�˫ԭ�ӷ��ӣ�������Ϊ���嵥�� |
 ��
����2��Ԫ��X��Ԫ��Z��ȣ��ǽ����Խ�ǿ����O����Ԫ�ط��ţ���д��һ���ܱ�ʾX��Z�ǽ�����ǿ����ϵ�Ļ�ѧ��Ӧ����ʽS+O2$\frac{\underline{\;��ȼ\;}}{\;}$SO2��2H2S+O2�T2H2O+2S��
��3��X��Y��Z��W����Ԫ���γɵ�һ�ֻ������ˮ��Һ��ǿ���ԣ��û�����Ļ�ѧʽΪNH4HSO4��д������ˮ��Һ�еĵ��뷽��ʽ��NH4HSO4=NH4++H++SO42-
��4��Ԫ��X��Ԫ��Y��ԭ�Ӹ�����1��1�����γɵĻ�����Q��Ԫ��W��Ԫ��Y�����γɵĻ�����M��Q��M�ĵ���������ȣ���MΪȼ�ϣ�QΪ����������������ƽ����������������ģ�������Ȼ�����ȶ����ڵ����ʣ�д���÷�Ӧ�Ļ�ѧ����ʽ��N2H4+2H2O2$\frac{\underline{\;��ȼ\;}}{\;}$N2+4H2O��