题目内容
14. 某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题:
某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题:(1)仪器A的名称是分液漏斗;FeCO3在C中生成(填字母),该装置中发生的主要反应的离子方程式为Fe2++2HCO3-═FeCO3↓+CO2↑+H2O.
(2)实验时首先打开活塞3,关闭活塞2,其目的是排出装置中的空气,防止+2价铁被氧化;然后再关闭活塞3,打开活塞2,其目的是使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中.
分析 A中为盐酸,与B中的铁粉反应生成FeCl2和氢气,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中,同时排除装置中的空气,防止亚铁离子被氧化,C装置中FeCl2和NH4HCO3发生反应:FeCl2+2NH4HCO3=FeCO3↓+2NH4Cl+CO2↑+H2O,D用来吸收二氧化碳气体,据此分析.
解答 解:(1)由仪器构造可知A为分液漏斗,FeCO3在C中生成,发生反应:Fe2++2HCO3-═FeCO3↓+CO2↑+H2O;
故答案为:分液漏斗;C;Fe2++2HCO3-═FeCO3↓+CO2↑+H2O;
(2)亚铁离子易被空气中氧气氧化,实验时首先打开活塞3,关闭活塞2,排出装置中的空气,防止+2价铁被氧化;
然后再关闭活塞3,打开活塞2,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中,
故答案为:排出装置中的空气,防止+2价铁被氧化;使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中.
点评 本题考查制备方案的设计,题目难度中等,涉及化学仪器识别、对操作的分析评价、离子方程式书写,明确实验原理为解题关键,是对学生综合能力的考查.

练习册系列答案
相关题目
4.利用海水提取溴和镁的过程如下,下列说法不正确的是 ( )
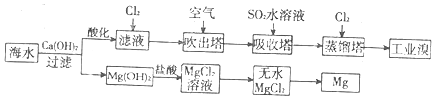

| A. | 若提取1 mol Br2,至少需要标准状况下44.8 L的Cl2 | |
| B. | 工业上常利用电解熔融MgCl2冶炼金属镁 | |
| C. | 富集溴元素过程中,空气吹出法利用了溴易挥发的性质 | |
| D. | 工业溴中含少量Cl2,可用氢氧化钠溶液除去 |
5.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-的数目为 NA | |
| B. | 0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA | |
| C. | 标准状况下,22.4LH2O含有的分子数为NA | |
| D. | 一定条件下2.3gNa与一定量氧气反应生成Na2O和Na2O2的混合物,转移的电子数一定为0.1NA |
2.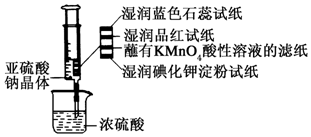 如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
 如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )| A. | 湿润的蓝色石蕊试纸只变红不褪色 | |
| B. | 湿润的品红试纸蘸有KMnO4酸性溶液的滤纸均褪色证明了SO2的漂白性 | |
| C. | 湿润的碘化钾淀粉试纸未变蓝说明SO2不能将I-还原为I2 | |
| D. | 实验后,可把注射器中的物质推入NaOH溶液,以减少环境污染 |
19.几种物质在酸性溶液中的还原性强弱顺序如下:SO2>I->Fe2+>H2O2.据此判断下列反应不能发生的是( )
| A. | 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ | B. | H2O2+H2SO4=SO2↑+O2↑+2H2O | ||
| C. | SO2+I2+2H2O=H2SO4+2HI | D. | 2Fe3++2I-=2Fe2++I2 |
5.下列离子方程式书写正确的是( )
| A. | 氧化亚铁溶于稀硝酸:FeO+2H+═Fe2++H2O | |
| B. | 往CaCl2溶液中通入少量的CO2:Ca2++CO2+H2O=CaCO3↓+2H+ | |
| C. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| D. | 向澄清石灰水中滴加少量的NaHCO3溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
3. 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )
 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )| A. | 从曲线变化可以看出,反应进行到10min至20min时可能采取的措施是使用了催化剂 | |
| B. | 25min时平衡正向移动但达到新平衡后 NH3的体积分数比原平衡大 | |
| C. | 反应开始到第一次平衡时,N2的平均反应速率为0.0625mol•(L•min)-1,H2的转化率为75% | |
| D. | 从曲线变化可以看出,反应进行至25min时,采取的措施是分离出0.1mol的氨气,平衡正向移动 |
